题目内容
【题目】下列关于化学键的叙述,正确的一项是
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
【答案】A
【解析】
A.离子化合物中一定含有离子键,可能含有共价键,如KOH中含有离子键和共价键,故A正确;
B.单质分子中有的含有化学键,如H2,有的不含化学键,如稀有气体分子,故B错误;
C.含有极性键的分子不一定是极性分子,如果分子正负电荷重心重合,则就是非极性分子,如CCl4,故C错误;
D.含有共价键的化合物不一定是共价键化合物,可能是离子化合物,如NH4Cl,故D错误;
故选A。

【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L 的盐酸与50mL0.55mol/L 的 NaOH 溶液在如图所示的装置中进行中和反应。 请回答下列问题:
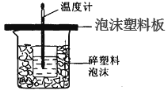
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________;由图可知该装 置有不妥之处,应如何改正?_____。
(2)实验中改用 60 mL0.50 mol/L 的盐酸跟 50mL 0.55 mol/L 的 NaOH 溶液进行反应,与 上述实验相比,所放出的热量_____(填“相等”或“不相等”);所求中和热的数值会_____(填“相等”或 “不相等”),理由是_____。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因 是_____。
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视计数
E.将 50mL0.55mol/L 氢氧化钠溶液取成了 50mL0.55mol/L 的氨水
(4)将 V1ml 1.0mol/L HCl 溶液和 V2ml 未知浓度的 NaOH 溶液混合均匀后测量并记录温 度,实验结果如下图所示(实验中始终保持 V1+V2=50mL)
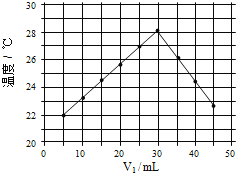
通过分析图像可知,做该实验时环境温度_____(填“高于”,“低于”或“等于”)22℃,该 NaOH 溶液的浓度约为_____mol/L。
(5)假设盐酸和氢氧化钠溶液的密度都是 1g·cm-3,又知中和反应后生成溶液的比热容 c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度 t1/℃ | 终止温度 t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_____(结果保留一位小数)。