题目内容
下列结论正确的是( )
①微粒半径:S2->Cl->S>F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④熔点:SiO2>NaCl>CO2
⑤酸性:H2SO4>HClO4>H2SeO4⑥碱性强弱:NaOH>Mg(OH)2>Al(OH)3.
①微粒半径:S2->Cl->S>F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④熔点:SiO2>NaCl>CO2
⑤酸性:H2SO4>HClO4>H2SeO4⑥碱性强弱:NaOH>Mg(OH)2>Al(OH)3.
分析:①阴离子半径大于对应的原子半径,核外电子排布相同的离子,核电核数越大,半径越小;
②⑤⑥从元素的金属性、非金属性的强弱的角度分析;
③根据单质的氧化性越强,则对应的阴离子的还原性越弱的角度分析;
④根据熔点:原子晶体>离子晶体>分子晶体分析.
②⑤⑥从元素的金属性、非金属性的强弱的角度分析;
③根据单质的氧化性越强,则对应的阴离子的还原性越弱的角度分析;
④根据熔点:原子晶体>离子晶体>分子晶体分析.
解答:解:①阴离子半径大于对应的原子半径,则S2->S,核外电子排布相同的离子,核电核数越大,半径越小,则S2->Cl-,
原子核外电子层数越多,半径越大,则S>F,则有S2->Cl->S>F,故①正确;
②已知非金属性:F>Cl>S>Te,元素的非金属性越强,对应氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>H2Te,故②正确;
③已知单质的氧化性Cl2>Br2>I2>S,单质的氧化性越强,则对应的阴离子的还原性越弱,离子的还原性:S2->I->Br->Cl-,故③错误;
④SiO2为原子晶体,NaCl为离子晶体,CO2为分子晶体,熔点顺序:原子晶体>离子晶体>分子晶体,故④正确;
⑤非金属性:Cl>S>Se,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则有HClO4>H2SO4>H2SeO4,故⑤错误;
⑥金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则有碱性强弱:NaOH>Mg(OH)2>Al(OH)3,故⑥正确.
故选A.
原子核外电子层数越多,半径越大,则S>F,则有S2->Cl->S>F,故①正确;
②已知非金属性:F>Cl>S>Te,元素的非金属性越强,对应氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>H2Te,故②正确;
③已知单质的氧化性Cl2>Br2>I2>S,单质的氧化性越强,则对应的阴离子的还原性越弱,离子的还原性:S2->I->Br->Cl-,故③错误;
④SiO2为原子晶体,NaCl为离子晶体,CO2为分子晶体,熔点顺序:原子晶体>离子晶体>分子晶体,故④正确;
⑤非金属性:Cl>S>Se,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则有HClO4>H2SO4>H2SeO4,故⑤错误;
⑥金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则有碱性强弱:NaOH>Mg(OH)2>Al(OH)3,故⑥正确.
故选A.
点评:本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
己知:2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
| A、H2的燃烧热△H=-241.8kJ?mol-1 | B、炭和和水蒸气转化为水煤气为放热反应 | C、将24g 炭完全转化为水煤气,再充分燃烧,整个过程反应热为-787.0kJ?mol-1 | D、1mol H2O(g)完全分解需要吸收241.8kJ热量 |
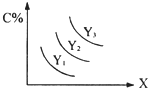 对于反应A(s)+2B(g?3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )
对于反应A(s)+2B(g?3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )| A、Y表示温度,X表示压强,且Y3>Y2>Y1 | B、Y表示压强,X表示温度,且Y3>Y2>Y1 | C、X表示压强,Y表示温度,且Y1>Y2>Y3 | D、X表示温度,Y表示压强,且Y1>Y2>Y3 |