题目内容
【题目】Ⅰ.某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x和y的关系如图所示。计算:

(1)该温度下水的离子积为___________
(2)该温度下,0.01 mol/L的NaOH溶液的pH为___________
Ⅱ.已知25 ℃时,Ka(CH3COOH)=1.6×10-5。
(1)向0.1 mol·L-1醋酸溶液中加入一定量1 mol·L-1盐酸时,上式中的数值是否发生变化________(填是或否)解释原因______________________
(2)若醋酸的起始浓度为0.010 mol·L-1,平衡时c(H+)=______________
Ⅲ. 已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=6.25×10-5mol·L-1。
若忽略水的电离及H2CO3的第二级电离,则H2CO3 ![]() HCO
HCO![]() +H+的平衡常数K1=________。(已知10-5.60=2.5×10-6)
+H+的平衡常数K1=________。(已知10-5.60=2.5×10-6)
【答案】 1.0×10-15 13 不变 电离常数不随浓度变化而变化,在一定温度下是一个常数 4×10-4 mol·L-1 10-7
【解析】Ⅰ.(1)根据图知,当c(H+)=1.0×10-5mol/L,c(OH-)=1.0×10-10mol/L,由离子积常数=c(H+)×c(OH-)=1.0×10-5×1.0×10-10=1.0×10-15,故答案为:1.0×10-15 ;
(2))该温度下,氢氧化钠溶液中氢离子浓度=![]() mol/L=10-13mol/L,pH=13,故答案为:13;
mol/L=10-13mol/L,pH=13,故答案为:13;
Ⅱ.(1)向醋酸溶液中加入盐酸,醋酸的电离平衡常数不变,因为电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故答案为:不变;电离常数不随浓度变化而变化,在一定温度下是一个常数;
(2)c(H+)=![]() =
=![]() mol/L=4×10-4mol/L,故答案为:4×10-4mol/L;
mol/L=4×10-4mol/L,故答案为:4×10-4mol/L;
Ⅲ. 饱和CO2水溶液的pH=5.60,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=6.25×10-5 molL-1,
则H2CO3![]() HCO3-+H+的平衡常数,K1═
HCO3-+H+的平衡常数,K1═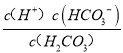 =
=![]() =1.0×10-7 molL-1,故答案为:1.0×10-7 molL-1。
=1.0×10-7 molL-1,故答案为:1.0×10-7 molL-1。

 名校课堂系列答案
名校课堂系列答案【题目】已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反 应速率v(CO)= 。

(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。