题目内容
(8分) 已知3A(g)+B(g)  xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5 min 内用C表示的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5 min 内用C表示的平均反应速率为0.1 mol/(L·min)。求:
(1)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)5min内用B表示的平均反应速率v(B)= ________mol/(L·min);
________mol/(L·min);
(3)此时A的转化率为_______,x的值为________。
(1) ___3__ ___mol; (2) v(B)=______0.05__mol/(L·min);
___mol; (2) v(B)=______0.05__mol/(L·min);
(3)____50%__,x的值为__2______。
解析

(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) CO(g)+3H2(g) I。
CO(g)+3H2(g) I。
CH4的转化率与温度、压强的关系如图所示。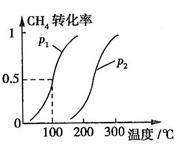
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的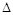 H 0。(填“<”、“>”或“=”)
H 0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 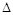 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充人lmolCO和3 mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强
 = MPa。
= MPa。
 xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5
min 内用C表示的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5
min 内用C表示的平均反应速率为0.1 mol/(L·min)。求: