题目内容
19.下列试剂能够使Fe2+转化为Fe3+的是( )| A. | KSCN溶液 | B. | 氢氧化钠溶液 | C. | 氯水 | D. | 铜粉 |
分析 使Fe2+转化为Fe3+,应加氧化剂如氯气、氯水、过氧化氢、硝酸等,以此来解答.
解答 解:A.Fe2+与KSCN溶液不反应,KSCN溶液可用于检验Fe3+,故A不选;
B.Fe2+与NaOH反应生成沉淀,故B不选;
C.Fe2+与氯水发生氧化还原反应生成Fe3+,故C选;
D.Fe2+与Cu不反应,Fe3+与Cu反应生成Fe2+、Cu2+,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
7. 某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )
某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )
 某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )
某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )| A. | 溶有SO2的品红溶液 | B. | 滴有酚酞的氨水溶液 | ||
| C. | 滴有酚酞的NaOH溶液 | D. | 滴有石蕊的盐酸溶液 |
14.如图是滴定管和量筒的两个液面.下列有关读数中正确的是( )
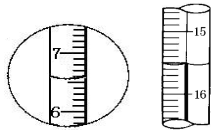

| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
4.下列实验操作能达到实验目的是( )
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |
1.合成结构简式 的高聚物,其单体应是( )
的高聚物,其单体应是( )
①苯乙烯
②丁烯
③1,3-丁二烯
④丙炔
⑤苯丙烯.
 的高聚物,其单体应是( )
的高聚物,其单体应是( )①苯乙烯
②丁烯
③1,3-丁二烯
④丙炔
⑤苯丙烯.
| A. | ①② | B. | ①③ | C. | ④⑤ | D. | ② |
2.某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如图:
已知:
①Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
②金属离子沉淀的PH如表一:
表一:
③不同温度下化合物的溶解度如表二:
表二:
请回答:
(1)操作A的名称是抽滤(或过滤),加入硫酸的目的是将K2CrO4转化为K2Cr2O7.
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O.
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥.则下列说法正确的是AC.
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可开大水龙头,使洗涤剂快速通过沉淀物有利于将杂质洗尽
(4)为测定产品的纯度,可用摩尔盐[(NH4)2SO4•FeSO4•6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作将移液管垂直放入稍倾斜的锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管.
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如表三:
表三:
则测得K2Cr2O7产品的纯度是98%(以质量分数表示).
已知:

①Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
②金属离子沉淀的PH如表一:
表一:
| 离子 | 开始沉淀的PH | 沉淀完全的PH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 4.1 |
表二:
| 物质 | 溶解度/(g/110g水) | ||
| 0℃ | 40℃ | 80℃ | |
| K2SO4 | 7.4 | 14.8 | 21.4 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
(1)操作A的名称是抽滤(或过滤),加入硫酸的目的是将K2CrO4转化为K2Cr2O7.
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O.
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥.则下列说法正确的是AC.
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可开大水龙头,使洗涤剂快速通过沉淀物有利于将杂质洗尽
(4)为测定产品的纯度,可用摩尔盐[(NH4)2SO4•FeSO4•6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作将移液管垂直放入稍倾斜的锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管.
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如表三:
表三:
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |

 .
.

