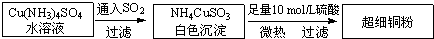题目内容
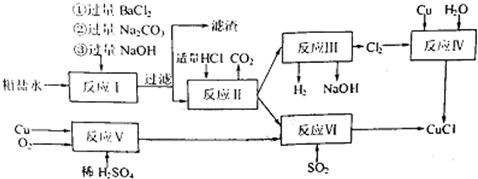
氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl- Ce4++Fe2+===Fe3++Ce3+ 通过计算说明上述样品中CuCl的质量分数是否符合标准。
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl- Ce4++Fe2+===Fe3++Ce3+ 通过计算说明上述样品中CuCl的质量分数是否符合标准。
(1)设需要CuSO4·5H2O的质量为x,H2O的质量为y CuSO4·5H2O的相对分子质量为250,CuSO4的相对分子质量为160 
16x=5(x+y)
x∶y = 5∶11
答:所需CuSO4·5H2O与H2O的质量之比为5∶11
(2)设样品中CuCl的质量为x 由化学反应方程式可知:CuCl ~ Fe2+ ~ Ce4+
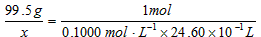
x=0.1000mol·L-1×24.60×10-3L×99.5g·mol-1=0.2448g
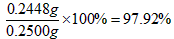
97.92%>96.50%
答:样品中CuCl的质量分数符合标准。

16x=5(x+y)
x∶y = 5∶11
答:所需CuSO4·5H2O与H2O的质量之比为5∶11
(2)设样品中CuCl的质量为x 由化学反应方程式可知:CuCl ~ Fe2+ ~ Ce4+
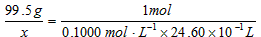
x=0.1000mol·L-1×24.60×10-3L×99.5g·mol-1=0.2448g
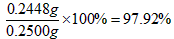
97.92%>96.50%
答:样品中CuCl的质量分数符合标准。

练习册系列答案
相关题目
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
Ⅱ、探究实验
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物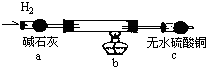
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是 ;
②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;
③写出装置b中发生反应的化学方程式: .
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质.
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物

实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O
②在c装置后将气体通入
③写出装置b中发生反应的化学方程式:
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入

 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.