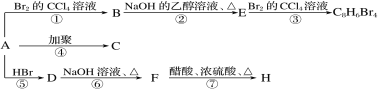
题目内容
【题目】回答一下回答以下关于第三周期元素及其化合物的问题。
(1)Na原子核外共有___种不同运动状态的电子,Al的原子结构示意图___。
(2)相同压强下,部分元素氟化物的熔点见表:

试解释上表中氟化物熔点差异的原因:___。
(3)SiF4分子的空间构型为____,SiF4中Si-F键间的键角是____。
(4)在P、S、Cl三种元素形成的氢化物中,热稳定性最大的是____(填氢化物的化学式)。
【答案】11 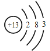 NaF、MgF2都为离子晶体,镁离子的半径比钠离子半径小,故MgF2中的离子键更强,所以熔点更高;四氯化硅为分子晶体,其熔点低于离子晶体。 正四面体 109°28′ HCl
NaF、MgF2都为离子晶体,镁离子的半径比钠离子半径小,故MgF2中的离子键更强,所以熔点更高;四氯化硅为分子晶体,其熔点低于离子晶体。 正四面体 109°28′ HCl
【解析】
(1)原子中没有运动状态相同的电子,Na原子核外有11个电子,故核外有11种不同运动状态的电子,铝原子核外13个电子原子,结构示意图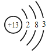 ;
;
答案为:11 ; 。
。
(2)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高;
(3)SiF4分子中,Si原子成4个SiF键,没有孤对电子,杂化方式为sp3,故SiF4分子空间结构为正四面体,键角为![]() ,
,
故答案为:正四面体;![]() ;
;
(4)同周期自左而右非金属性增强,故非金属性Cl>S>P,非金属性越强氢化物越稳定,故稳定性HCl>H2S>PH3。
故答案为:HCl。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目