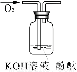题目内容
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其组成,做了如下实验,回答:
(1)往用水湿润的红纸中滴入少量新制饱和氯水,观察到 现象,说明饱
和氯水中含有 。
(2)在试管中加入少量的块状碳酸钙,再加入适量饱和氯水,充分反应,有少量气泡产
生,用离子方程式解释此现象 。
(1)纸张红色退去 HClO(或名称)
(2)CaCO3+2 H+ = Ca2+ + CO2 ↑+ H2O
【解析】
试题分析:(1)因为饱和新制氯水中有次氯酸,具有强氧化性,所以纸张红色退去
(2)氯水显酸性,与碳酸钙反应产生二氧化碳气体,离子方程式是CaCO3+2H+=Ca2++CO2↑+H2O,碳酸钙难溶不可拆开
考点:考查氯水的成分及离子方程式的书写

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O = 4NaOH + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
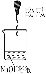
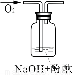
实验编号 | 1 | 2 | 3 |
实验装置 | | | |
验证猜想 |
| C |
|
实验现象 | 溶液变红后不退色 | ||
实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
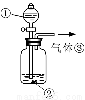
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。