题目内容
12.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•({H}_{2}O)}$,在不同的温度下该反应的平衡常数如下表:| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,该反应达到平衡状态时,生成CO2为0.4 mol | |
| D. | 若平衡浓度符合关系式$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1 000℃ |
分析 A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,幂次方为化学方程式计量数,据此书写化学方程式;
B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应;
C、依据化学平衡三段式列式计算浓度商和平衡常数比较分析判断;
D、计算此时平衡常数结合图表数据判断.
解答 解:A、平衡常数表达式为K=$\frac{c(CO{\;}_{2}).c(H{\;}_{2})}{c(CO).c(H{\;}_{2}O)}$,化学方程式为CO+H2O=CO2+H2,故A正确;
B、平衡常数随温度升高减小,说明平衡逆向进行,逆向为吸热反应,正反应为放热反应,故B正确;
C、若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,
CO(g)+H2O(g)═CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.4 0.4 0.4 0.4
平衡量(mol) 0.6 0.6 0.4 0.4
反应前后气体物质的量不变,可以用其他物质的量代替平衡浓度计算,Q=$\frac{0.4×0.4}{0.6×0.6}$=0.4<K=1,此时平衡正向进行,故C错误;
D、若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则$\frac{c(CO{\;}_{2}).c(H{\;}_{2})}{c(CO).c(H{\;}_{2}O)}$=0.6,所以此时的温度为1000℃,故D正确;
故选C.
点评 本题考查了平衡常数书写方法,计算应用,平衡常数影响因素的分析判断,掌握基础是关键,题目难度中等.

| 选项 | 实 验 | 现 象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
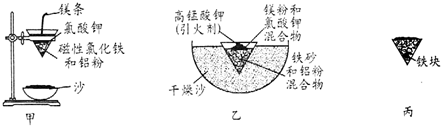
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡胶塞 |
| A. | 稀硫酸滴在铜片上 Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化镁与盐酸的反应 H++OH-=H2O | |
| C. | 澄清石灰水与盐酸的反应 Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加聚反应 |
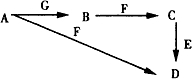 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题