题目内容
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.7kJ·mol-1
CH3OH(g)△H1=-90.7kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41.2kJ·mol-1
CO2(g)+H2(g)△H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 (填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
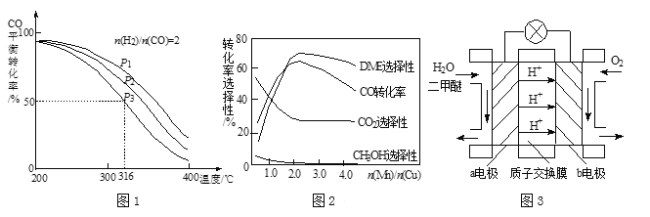
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 (填字母)。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 (填字母)。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
【答案】(1)-246.1;(2)AC;
(3)消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;
(4)A;(5)2.0;(6)CH3OCH3-12e-+3H2O=2CO2↑+12H+。
【解析】
试题分析:(1)2×①+②+③得出:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1;(2)A、使用CO,增加反应物浓度,平衡向正反应方向移动,二甲醚的产量增加,故正确;B、此反应是放热反应,升高温度,平衡向逆反应方向移动,消耗二甲醚,二甲醚的产量降低,故错误;C、增大压强,平衡向体积减小的方向移动,即向正反应方向移动,二甲醚的产量增大,故正确;(3) 消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;(4)A、随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,根据勒夏特列原理,正反应是放热反应,即△H<0,故正确;B、作等温线,以及反应方程式,增大压强平衡向正反应方向移动,CO的转化率增大,即P1>P2>P3,故错误;C、相当于在原来的基础上通入氢气,增反应物的浓度,平衡向正反应方向移动,CO的转化率增大,即大于50%,故错误;(5)根据图2,最有利于二甲醚的生成,DME选择性最大,CO的转化率最大,CO2和CH3OH的选择性最小,因此为2.0时最好;(6)根据H+移动的方向,以及原电池的工作原理,a极为负极,b极为正极,因此电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。
CH3OCH3(g)+CO2(g) △H=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1;(2)A、使用CO,增加反应物浓度,平衡向正反应方向移动,二甲醚的产量增加,故正确;B、此反应是放热反应,升高温度,平衡向逆反应方向移动,消耗二甲醚,二甲醚的产量降低,故错误;C、增大压强,平衡向体积减小的方向移动,即向正反应方向移动,二甲醚的产量增大,故正确;(3) 消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;(4)A、随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,根据勒夏特列原理,正反应是放热反应,即△H<0,故正确;B、作等温线,以及反应方程式,增大压强平衡向正反应方向移动,CO的转化率增大,即P1>P2>P3,故错误;C、相当于在原来的基础上通入氢气,增反应物的浓度,平衡向正反应方向移动,CO的转化率增大,即大于50%,故错误;(5)根据图2,最有利于二甲醚的生成,DME选择性最大,CO的转化率最大,CO2和CH3OH的选择性最小,因此为2.0时最好;(6)根据H+移动的方向,以及原电池的工作原理,a极为负极,b极为正极,因此电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案