题目内容
2.一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是( )| A. | 加入的碱过量 | |
| B. | 生成的盐发生水解 | |
| C. | 混合前酸与碱中溶质的物质的量相等 | |
| D. | 反应后溶液中c(A-)=c(M+) |
分析 一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,则有c(OH-)=c(H+),根据电荷守恒可知:c(A-)=c(M+);若MOH为强碱,则酸和碱的物质的量相等,若MOH为弱碱,则碱应过量,以此进行分析.
解答 解:A.若MOH为强碱,则酸和碱的物质的量相等,故A错误;
B.若MOH为强碱,则反应生成强酸强碱盐,生成的盐不水解,故B错误;
C.若MOH为弱碱,则碱应过量,混合前酸与碱中溶质的物质的量不等,故C错误;
D.溶液呈中性,则有c(OH-)=c(H+),根据溶液中的电荷守恒可知:c(A-)=c(M+),故D正确;
故选D.
点评 本题考查酸碱混合的计算与判断,题目难度中等,明确碱的强弱是解答本题的关键,并注意掌握电荷守恒在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
13.下列说法中错误的是( )
| A. | 燃料的燃烧反应都是放热反应 | |
| B. | 一定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 加热后才能发生的化学反应是吸热反应 | |
| D. | 放热反应的逆反应一定是吸热反应 |
17.下列物质中,导电性由大到小排列正确的是( )
①500mL 0.1mol/L 的盐酸溶液; ②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液; ④1L 0.1mol/L 的酒精溶液.
①500mL 0.1mol/L 的盐酸溶液; ②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液; ④1L 0.1mol/L 的酒精溶液.
| A. | ①②③④ | B. | ④①③② | C. | ②①③④ | D. | ①③②④ |
7.在温度不变,恒荣的容器中进行反应2A?B+C,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L需用时间可能为( )
| A. | 8s | B. | 10s | C. | 12s | D. | 14s |
14.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:
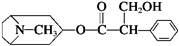
下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应,
其中错误的是( )

下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应,
其中错误的是( )
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
11.A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于非极性分子(填“极性”或“非极性”),化合物乙的电子式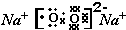 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
(3)元素B、D组成化合物丙,其晶体类型为离子晶体,化合物丙的溶液呈碱性(填“酸性”“碱性”或“中性”).
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高.
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65kJ 热量.则表示化合物丁的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.4KJ/mol.
②某实验小组依据丁燃烧的反应原理,设计如图所示的电池装置.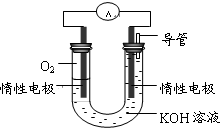
a.该电池正极的电极反应为O2+2H2O+4e-=4OH-.
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O.
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:BeO+2OH-=BeO22-+H2O.若E的氯化物熔沸点较低、易升华,则E的氯化物是共价化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择将其加热到熔融状态,做导电性实验,看其能否导电.
| 元素 | A | B | C | D | E | F |
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于非极性分子(填“极性”或“非极性”),化合物乙的电子式
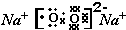 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.(3)元素B、D组成化合物丙,其晶体类型为离子晶体,化合物丙的溶液呈碱性(填“酸性”“碱性”或“中性”).
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高.
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65kJ 热量.则表示化合物丁的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.4KJ/mol.
②某实验小组依据丁燃烧的反应原理,设计如图所示的电池装置.

a.该电池正极的电极反应为O2+2H2O+4e-=4OH-.
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O.
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:BeO+2OH-=BeO22-+H2O.若E的氯化物熔沸点较低、易升华,则E的氯化物是共价化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择将其加热到熔融状态,做导电性实验,看其能否导电.
12.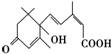 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )| A. | S-诱抗素含有碳碳双键、羟基、羰基、羧基 | |
| B. | S-诱抗素分子式为C16H18O2 | |
| C. | S-诱抗素能发生加成反应、水解反应、氧化反应 | |
| D. | 1mol S-诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
