题目内容
已知2SO2(g)+ O2(g) ![]() 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
A.Q2= 1/2 Q1=98.5 B.Q2=1/2 Q1<98.5 C.Q2<1/2 Q1<98.5 D.1/2 Q1< Q2 <98.5
C
解析:
该试题考查化学平衡与反应热的综合知识,较难。根据加入的量,可知甲乙为等效平衡,但甲向正反应进行的程度大于乙向正反应进行的程度,且放出的能量大于其二倍。

练习册系列答案
相关题目
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2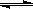 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s) ===C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.已知2C(s) +2O2 (g) ===2CO2(g) △H1 |
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: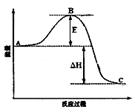
 2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是