题目内容
(14分)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~F涉及H2O2的反应,回答相关问题:
A.Na2O2 +2HCl= 2NaCl+H2O2
B.Ag2O+ H2O2=2Ag+O2↑+ H2O
C.2 H2O2="2" H2O+O2↑
D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O
E.H2O2+MnSO4 = MnO2 + H2SO4
F. H2O2 + Fe2+ + H+ ="=" Fe3+ + H2O
(1)上述反应不属于氧化还原反应的是(填代号)_____________。
(2)H2O2仅体现还原性的反应是(填代号) 。
(3)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(4)H2O2体现酸性的反应是(填代号) 。
(5)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
(6)通过以上反应分析, H2O2常称为绿色氧化剂,原因是_______________________。
(7)请配平化学反应F,并画出电子转移情况。
H2O2 + Fe2+ + H+ ="=" Fe3+ + H2O
(8)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失。为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设。请回答:
(A)该学生提出的两种假设是:
假设①___________________________________________;
假设② _________________________________ 。
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
A.Na2O2 +2HCl= 2NaCl+H2O2
B.Ag2O+ H2O2=2Ag+O2↑+ H2O
C.2 H2O2="2" H2O+O2↑
D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O
E.H2O2+MnSO4 = MnO2 + H2SO4
F. H2O2 + Fe2+ + H+ ="=" Fe3+ + H2O
(1)上述反应不属于氧化还原反应的是(填代号)_____________。
(2)H2O2仅体现还原性的反应是(填代号) 。
(3)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(4)H2O2体现酸性的反应是(填代号) 。
(5)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
(6)通过以上反应分析, H2O2常称为绿色氧化剂,原因是_______________________。
(7)请配平化学反应F,并画出电子转移情况。
H2O2 + Fe2+ + H+ ="=" Fe3+ + H2O
(8)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失。为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设。请回答:
(A)该学生提出的两种假设是:
假设①___________________________________________;
假设② _________________________________ 。
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
| 简单实验方案 | 预测的实验现象 | 结论 |
| | | 假设____成立 |
| | 假设____成立 |
(1)A (2)B (3)C (4)A (5)Ag2O > H2O2 > K2CrO4
(6)还原产物通常为水,对环境无污染。(以上每空答对得1分)
(7)(配平2分,电子转移1分)

(8)(A) (2分)
过氧化氢与NaOH发生中和反应(1分); 过氧化氢将酚酞氧化(1分)。
(B) (3分)
(6)还原产物通常为水,对环境无污染。(以上每空答对得1分)
(7)(配平2分,电子转移1分)

(8)(A) (2分)
过氧化氢与NaOH发生中和反应(1分); 过氧化氢将酚酞氧化(1分)。
(B) (3分)
| 简单实验方案 | 预测的实验现象 | 结论 |
| 向褪色后的溶液中再加入过量NaOH溶液(1分) | 溶液又变红色 | ①(共1分) |
| 溶液颜色无变化(依然为无色) | ②(共1分) |
(1)凡是有元素化合价升降的反应就是氧化还原反应,所以只有选项A不是氧化还原反应。
(2)在氧化还原反应中化合价升高的物质是还原剂,还原剂具有还原性。B中双氧水中氧原子的化合价由-1价升高到0价,作还原剂,正确。C是复分解反应,既作氧化剂,又作还原剂。DEF中双氧水中氧原子的化合价由-1价降低到-2价,作氧化剂。
(3)见解析(2)
(4)在选项A中过氧化钠可以看作是过氧化氢的盐,因此A正确。
(5)根据氧化还原反应中,氧化剂的氧化性大于氧化产物的可知,氧化性强弱是Ag2O > H2O2 > K2CrO4。
(6)由于过氧化氢的还原产物通常为水,对环境无污染,所以常被称作是绿色还原剂。
(7)可根据氧化还原反应中电子的得失守恒解析配平。1mol过氧化氢得到2mol电子,而1mol亚铁离子只能失去1mol电子,所以氧化剂和还原剂的物质的量之比是1︰2。
(8)溶液褪色,可能是溶液的碱性降低即被过氧化氢中和。另外一种可能就是过氧化氢的漂白使其褪色的。如果是因为被中和而颜色消失,则继续加入氢氧化钠溶液时,还会恢复红色。由于过氧化氢的漂白是氧化导致的,因此如果是被氧化而褪色,则再加入氢氧化钠溶液不会恢复红色,据此可以鉴别。
(2)在氧化还原反应中化合价升高的物质是还原剂,还原剂具有还原性。B中双氧水中氧原子的化合价由-1价升高到0价,作还原剂,正确。C是复分解反应,既作氧化剂,又作还原剂。DEF中双氧水中氧原子的化合价由-1价降低到-2价,作氧化剂。
(3)见解析(2)
(4)在选项A中过氧化钠可以看作是过氧化氢的盐,因此A正确。
(5)根据氧化还原反应中,氧化剂的氧化性大于氧化产物的可知,氧化性强弱是Ag2O > H2O2 > K2CrO4。
(6)由于过氧化氢的还原产物通常为水,对环境无污染,所以常被称作是绿色还原剂。
(7)可根据氧化还原反应中电子的得失守恒解析配平。1mol过氧化氢得到2mol电子,而1mol亚铁离子只能失去1mol电子,所以氧化剂和还原剂的物质的量之比是1︰2。
(8)溶液褪色,可能是溶液的碱性降低即被过氧化氢中和。另外一种可能就是过氧化氢的漂白使其褪色的。如果是因为被中和而颜色消失,则继续加入氢氧化钠溶液时,还会恢复红色。由于过氧化氢的漂白是氧化导致的,因此如果是被氧化而褪色,则再加入氢氧化钠溶液不会恢复红色,据此可以鉴别。

练习册系列答案
相关题目
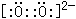
 l2________ mL。
l2________ mL。