题目内容
室温下,取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为
| A.0.01 mol?L-1 | B.0.017 mol?L-1 | C.0.05 mol?L-1 | D.0.50 mol?L-1 |
C
解析试题分析:设原溶液浓度为c,盐酸和氢氧化钠溶液混合后pH=12,说明碱过量,所以过量的氢氧化钠物质的量为(3cV-2cV)mol=cVmol,氢氧根离子浓度为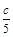 mol/L,pH=12可得氢氧根离子浓度为0.01mol/L,所以c=0.05mol/L。
mol/L,pH=12可得氢氧根离子浓度为0.01mol/L,所以c=0.05mol/L。
考点:pH计算
点评:酸碱混合后pH计算注意:若是酸过量,计算出过量的氢离子浓度再求pH;若是碱过量,先计算出过量的氢氧根离子浓度,再换算出氢离子物质的量浓度,最后求pH。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
室温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
| A.0.01 mol/L | B.0.017 mol/L | C.0.05 mol/L | D.0.50 mol/L |