题目内容
9.金属钠在空气中燃烧生成过氧化钠,下列说法正确的是( )
| A. | 该反应过程中的能量变化如图所示 | |
| B. | 生成的过氧化钠属于碱性氧化物 | |
| C. | 反应中每消耗1molO2转移2mol电子 | |
| D. | 过氧化钠与氧化钠所含化学键完全相同 |
分析 A.由图可知,生成物总能量大于反应物总能量;
B.与酸反应生成盐和水的氧化物为碱性氧化物;
C.O元素的化合价由0降低为-1价;
D.过氧化钠含离子键、O-O非极性共价键,氧化钠只含离子键.
解答 解:A.由图可知,生成物总能量大于反应物总能量,则为吸热反应,而燃烧为放热反应,故A错误;
B.与酸反应生成盐和水的氧化物为碱性氧化物,过氧化钠与酸反应还生成氧气,不是碱性氧化物,故B错误;
C.O元素的化合价由0降低为-1价,则每消耗1molO2转移1mol×2×1=2mol电子,故C正确;
D.过氧化钠含离子键、O-O非极性共价键,氧化钠只含离子键,化学键不完全相同,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、燃烧反应为放热反应、化学键、转移电子为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
| A. | 卤素单质的熔点按F2、Cl2、Br2、I2的顺序依次减小 | |
| B. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| C. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 | |
| D. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
17.元素周期表中几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |
2.二氯化碳利用具有十分重要的意义,科学家有以下几个设想.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.
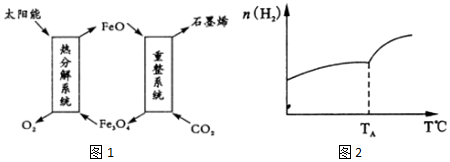
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
则反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数k=1.25×10-3.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.

(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
9.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
7. 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )| A. | X原子可能为VA族元素 | |
| B. | Y原子一定为IA族元素 | |
| C. | 该分子中,既含极性键,又含氢键 | |
| D. | 从圆球的大小分析,该分子可能为N2F4 |
