题目内容
1. 如图所示,电化学实验装置.
如图所示,电化学实验装置.(1)若烧杯中盛有CuSO4溶液.
①石墨电极上的电极反应:4OH--4e-=O2↑+2H2O
②电解一段时间后,若要使装置中溶液恢复到电解前的状态,可向溶液中加 入CuO;(填写物质的化学式)
(2)起初,若装置中盛有1L含有0.4mol CuSO4和0.2mol NaCl的水溶液.电解一段时间后,在一个电极上得到0.3mol Cu,另一电极上析出气体(在标准状况下)的体积是4.48L,此时溶液的H+离子浓度是0.4mol.L-1.(溶液体积变化不计)
分析 (1)在电解池中,电子是从阳极沿着导线移向阴极,所以石墨是阳极,Fe是阴极,在阳极上发生失电子的还原反应;
②电解质溶液复原:出什么加什么;
(2)电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积;根据电极上电子转移为0.4mol,4OH--4e-=2H2O+O2↑,反应的氢氧根的物质的量就是氢离子的物质的量.
解答 解:(1)①(1)在电解池中,电子是从阳极沿着导线移向阴极,所以石墨是阳极,Fe是阴极,在阳极上发生失电子的还原反应:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
②在阳极上产生氧气,在阴极上析出金属铜,所以若要使装置中溶液恢复到电解前的状态,可向溶液中加CuO,故答案为:CuO;
(2)电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol,阴极上转移电子的物质的量=0.3mol×2=0.6mol,
根据原子守恒知,溶液中n(Cl-)=0.2mol,氯离子完全放电时转移电子的物质的量=0.2mol×1=0.2mol,生成氯气0.1mol;
所以阳极上有氧气生成,电极上电子转移为0.4mol,4OH--4e-=2H2O+O2↑,电极反应计算生成氧气0.1mol,所以阳极生成气体物质的量为0.2mol,标准状况下气体的体积为4.48L;根据电极上电子转移为0.4mol,4OH--4e-=2H2O+O2↑,反应的氢氧根的物质的量就是氢离子的物质的量=0.4mol.溶液的体积是1L,浓度为0.4mol.L-1,故答案为:4.48L;0.4mol.L-1.
点评 本题以电解原理为载体考查了物质的量的有关计算,明确阳极上析出气体的成分再结合转移电子相等即可解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①2A-+B2=2B-+A2
②2A-+C2=2C-+A2
③2B-+C2=2C-+B2
④2C-+D2=2D-+C2.
| A. | A->B->C->D- | B. | D->C->B->A- | C. | D->B->A->C- | D. | A->C->D->B- |
| A. | 非金属氧化物 酸性氧化物 | B. | 化合物 非电解质 | ||
| C. | 溶液 胶体 | D. | 悬浊液 分散系 |
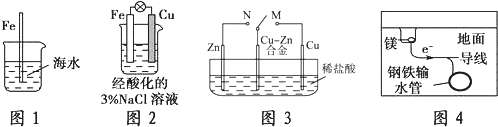
| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 | |
| C. | 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 | |
| D. | 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 |
| A. | Cl2是一种黄绿色、密度比空气大的有毒气体 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧FeCl3 | |
| C. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 | |
| D. | Cl2的氧化性比Br2强,而Br-的还原性却比Cl-强 |
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 铜、铝、钠可以分别用热还原法、热分解法和电解冶炼 | |
| C. | 电解从海水中得到的氯化镁溶液可获得金属镁 | |
| D. | 工业上用铝热反应来冶炼铁 |
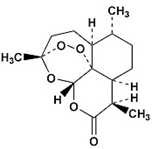 我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中含氧官能团只有酯基 | |
| C. | 青蒿素的化学式是C15H22O5 | |
| D. | 青蒿素属于烃类有机物 |
| A. | 溶剂的质量为:(dV-0.208Vc)g | |
| B. | 溶质的质量分数为:$\frac{208c}{d}$% | |
| C. | 溶质和溶剂的质量之比为:0.208Vc:(dV-0.208Vc) | |
| D. | Cl-的物质的量为:0.002Vc mol |