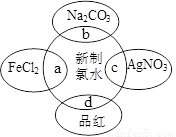
题目内容
新制氯水中含有多种成分,分别做如下实验:
①将足量NaOH溶液滴入氯水中,产生氯水褪色现象,起作用的成分________
②将鲜花浸入氯水中会褪色,起作用的成分是________
③向淀粉碘化钾中加入氯水显蓝色,起作用的成分是________.
HCI、HCIO HCIO HCIO、CI2
分析:氯气溶于水是可逆反应,氯气、次氯酸都具有强氧化性,根据溶液中成分的化学性质分析.
解答:溶液中存在反应:Cl2+H2O HCl+HClO,是可逆反应,存在电离:H2O
HCl+HClO,是可逆反应,存在电离:H2O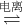 H++OH-,HClO
H++OH-,HClO 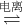 H++ClO-,
H++ClO-,
HCl=H++Cl-.所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-
①、氢氧化钠与盐酸和次氯酸反应:HCl+NaOH=NaCl+H2O,HClO+NaOH=NaClO+H2O,使平衡:Cl2+H2O HCl+HClO向正反应方向移动,氯水褪色,所以起作用的是盐酸和次氯酸.
HCl+HClO向正反应方向移动,氯水褪色,所以起作用的是盐酸和次氯酸.
故答案为:HCI、HCIO
②、氯气使湿润的有色物质褪色原理是氯气与水反应生成盐酸和次氯酸,HCIO有强氧化性,可以氧化有色物质而漂白,所以将鲜花浸入氯水中会褪色,起作用是HCIO.
故答案为:HCIO
③、向淀粉碘化钾中加入氯水显蓝色,说明I-被氧化成I2,HCIO、Cl2有强氧化性,可将I-氧化成I2,但应主要考虑
Cl2.所以起作用的是HClO、Cl2
故答案为:HClO、Cl2
点评:知道溶液中存在的微粒及其化学性质是解本题的关键,根据反应方程式了解反应的实质,判断起作用的成分.
分析:氯气溶于水是可逆反应,氯气、次氯酸都具有强氧化性,根据溶液中成分的化学性质分析.
解答:溶液中存在反应:Cl2+H2O
 HCl+HClO,是可逆反应,存在电离:H2O
HCl+HClO,是可逆反应,存在电离:H2O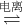 H++OH-,HClO
H++OH-,HClO 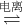 H++ClO-,
H++ClO-,HCl=H++Cl-.所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-
①、氢氧化钠与盐酸和次氯酸反应:HCl+NaOH=NaCl+H2O,HClO+NaOH=NaClO+H2O,使平衡:Cl2+H2O
 HCl+HClO向正反应方向移动,氯水褪色,所以起作用的是盐酸和次氯酸.
HCl+HClO向正反应方向移动,氯水褪色,所以起作用的是盐酸和次氯酸.故答案为:HCI、HCIO
②、氯气使湿润的有色物质褪色原理是氯气与水反应生成盐酸和次氯酸,HCIO有强氧化性,可以氧化有色物质而漂白,所以将鲜花浸入氯水中会褪色,起作用是HCIO.
故答案为:HCIO
③、向淀粉碘化钾中加入氯水显蓝色,说明I-被氧化成I2,HCIO、Cl2有强氧化性,可将I-氧化成I2,但应主要考虑
Cl2.所以起作用的是HClO、Cl2
故答案为:HClO、Cl2
点评:知道溶液中存在的微粒及其化学性质是解本题的关键,根据反应方程式了解反应的实质,判断起作用的成分.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目