题目内容
(共12分)
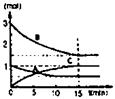
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:

①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
①K=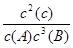 ②不变 增大 ③
0.01mol/(L·min)
②不变 增大 ③
0.01mol/(L·min)
(2)① 降温 ②AC
【解析】
试题分析:(1)?反应平衡常数K值只与温度有关,与反应物浓度无关。其他条件相同时,
增大反应物浓度反应速率增大。?计算平均反应速率,以反应物B为例:V(B)=1.5mol/15min
×10L (2)?在t2时反应速率骤降,温度降低,分子运动速率减慢,反应速度也减慢。
?影响反应速率的因素有温度、浓度、压强、催化剂,在t4时反应速率升高,对于有气体
参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,
速率增加。正催化剂能使反应速率增加。选项D、E升高温度与增大A浓度虽然能使反应速
率增加,但会是平衡移动,故不符合。
考点:反应速率、反应平衡及计算;影响反应速率的因素;
点评:综合考查学生对反应速率章节内容的掌握:
①反应平衡常数K值只与温度有关,与反应物浓度无关。②影响反应速率的因素有温度、浓
度、压强、催化剂;③对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,
即体积减小,反应物浓度增大,速率增加。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 褐色
褐色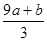 mol
mol