题目内容
【题目】甲、乙、丙三位同学分别欲用图所示实验装置制取并收集氨气. 
(1)其中有一位同学没有收集到氨气,你认为没有收集到氨气的同学是(填“甲”或“乙”或“丙”),原因是 .
(2)要制取纯净的氨气,应该选用(填“甲”或“乙”或“丙”)同学的装置.为确定试管内是否已收集满氨气,可将蘸浓盐酸的玻璃棒置于收集气体的试管口处,若观察到 , 则说明氨气已收集满.
【答案】
(1)乙;浓硫酸吸收氨气
(2)丙;试管口冒白烟
【解析】解:三位同学制取氯气方法都是用氯化铵和氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,氨气比空气轻,极易溶于水,采用向下排气法收集,氨气是碱性气体用碱石灰干燥气体,(1)浓硫酸为碱性气体,能够与氨气反应吸收氨气,不能干燥氨气,所以乙同学不能收集到氨气;
CaCl2+2NH3↑+2H2O,氨气比空气轻,极易溶于水,采用向下排气法收集,氨气是碱性气体用碱石灰干燥气体,(1)浓硫酸为碱性气体,能够与氨气反应吸收氨气,不能干燥氨气,所以乙同学不能收集到氨气;
所以答案是:乙;浓硫酸吸收氨气;(2)甲装置中生成的氨气含水蒸气,乙装置中氨气和浓硫酸反应不能制备氨气,丙装置中碱石灰干燥氨气,最后得到纯净的氨气,氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,所以为确定试管内是否已收集满氨气,用蘸有浓盐酸的玻璃棒置于收集气体的试管口处,若观察到试管口白烟产生,则说明氨气已收集满,反应为:NH3+HCl=NH4Cl,
所以答案是;丙;试管口冒白烟.
【考点精析】根据题目的已知条件,利用氨的实验室制法的相关知识可以得到问题的答案,需要掌握安验室制法:用铵盐与碱共热,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1 )称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
(2 )将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2 )A的分子式为: . |
(3 )另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3 )该有机物分子中含有羟基、羧 |
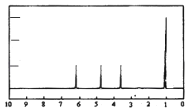
(4 )A的核磁共振氢谱如图: | (4 )A中含有种氢原子. |
(5 )综上所述,A的结构简式 , | |