题目内容
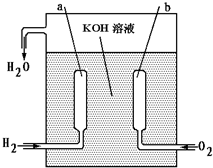
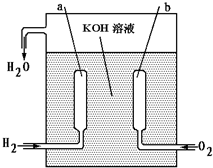 我国“神舟”号宇宙飞船成功发射并回收,是我国航天史上的里程碑. 飞船上使用的氢氧燃料电池是一种新型的化学电源,它具有高能、轻便、不污染环境的特点.这种燃料电池的构造如右图所示,两个电极均由多空性碳制成,通入的气体由空隙逸出并在电极表面放电.
我国“神舟”号宇宙飞船成功发射并回收,是我国航天史上的里程碑. 飞船上使用的氢氧燃料电池是一种新型的化学电源,它具有高能、轻便、不污染环境的特点.这种燃料电池的构造如右图所示,两个电极均由多空性碳制成,通入的气体由空隙逸出并在电极表面放电.a极是
负
负
极,b极是正
正
极,写出电极反应式a:负极:2H2-4e-+4OH-=4H2O;(或H2-2e-+2OH-=2H2O)
负极:2H2-4e-+4OH-=4H2O;(或H2-2e-+2OH-=2H2O)
;b:
正极:O2+4e-+2H2O=4OH-
正极:O2+4e-+2H2O=4OH-
;总反应式:
2H2+O2=2H2O
2H2+O2=2H2O
.分析:氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极经外电路流向正极,氢氧燃料电池的总反应为:2H2+O2=2H2O.
解答:解:氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,
由于电解质溶液呈碱性,则负极电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),
正极电极反应式为O2+4e-+2H2O=4OH-,
氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,
为:2H2+O2=2H2O.
故答案为:负;正;负极:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);正极:O2+4e-+2H2O=4OH-;2H2+O2=2H2O.
由于电解质溶液呈碱性,则负极电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),
正极电极反应式为O2+4e-+2H2O=4OH-,
氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,
为:2H2+O2=2H2O.
故答案为:负;正;负极:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);正极:O2+4e-+2H2O=4OH-;2H2+O2=2H2O.
点评:本题考查原电池的工作原理,题目难度不大,注意电极方程式的书写以及电解质溶液的酸碱性.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目