题目内容
【题目】碱式碳酸铜表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
采用氢气还原法,请回答如下问题:
(1)xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式______________________________
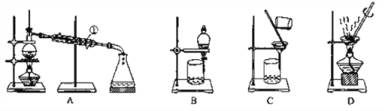
(2)下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(l)
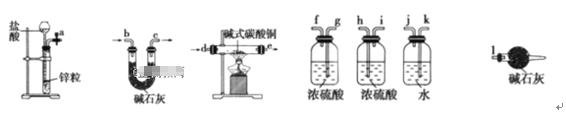
(3)23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为__________ g,化学式为____________。
【答案】xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)CuO+xCO2↑+(x+2y+z)H2O k j g(或h) f(或i) d e h(或g) i(或f) b c 1.8 g CuCO3·Cu(OH)2·H2O
(x+y)CuO+xCO2↑+(x+2y+z)H2O k j g(或h) f(或i) d e h(或g) i(或f) b c 1.8 g CuCO3·Cu(OH)2·H2O
【解析】
(1)与氢气反应的产物有:Cu、CO2、H2O,书写化学方程式;
(2)本实验的原理,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
(3)根据题中所给数据可计算出单质铜、水、二氧化碳的物质的量,求出碱式碳酸铜的化学式,计算出结晶水的物质的量。
(1)xCuCO3·yCu(OH)2·zH2O与氢气反应生成单质铜、水、二氧化碳,反应方程式为:xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)CuO+xCO2↑+(x+2y+z)H2O。
(x+y)CuO+xCO2↑+(x+2y+z)H2O。
(2)实验中要测定生成的水、二氧化碳的量,从a口出来气体中含有水蒸气和挥发出来的氯化氢气体,会对实验造成干扰,应先用水吸收氯化氢气体,再用浓硫酸吸收水蒸气;之后,与碱式碳酸铜发生反应,产生的两种气体先用浓硫酸吸收水蒸气,再用U型管中的碱石灰吸收二氧化碳,同时连上装有碱石灰的球形干燥管,避免空气中的水和二氧化碳进入U型管而产生误差,因此装置的连接顺序为:a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
本题答案为:k 、 j 、. g(或h) 、f(或i) 、d 、 e、 h(或g) 、i(或f) 、b 、c。
(3)根据题中所给数据可计算出单质铜、水、二氧化碳的物质的量为0.2mol、0.4mol、0.1mol,因此可知(x+y):x:(x+2y+z)=2:1:4,则x、y、z分别为1、1、1,该样品的化学式为CuCO3Cu(OH)2H2O,结晶水的质量为7.2g/4g=1.8g,该样品的化学式为CuCO3Cu(OH)2H2O。

【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_________。
(2)已知:反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
①在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在低温时选择反应_____(填“I”或“II”)。

③520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
A.降低反应温度 B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比 D. 充入一定量的氦气
(3)己知25℃时HCN和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7×10-11 |
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为______,向NaCN溶液中通入少量CO2,则发生反应的化学方程式为:______________________。