题目内容
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
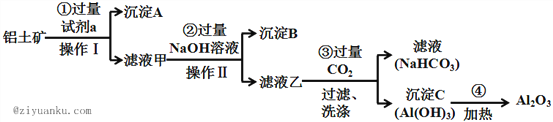
(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。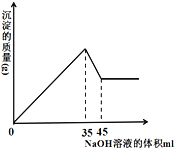
【答案】 SiO2 Fe3++3OH﹣=Fe(OH)3 Al3++4OH﹣=[Al(OH)4]﹣ 过量盐酸能使生成的Al(OH)3溶解 63.75%
【解析】铝土矿中加入过量试剂a,然后操作I得到沉淀A和滤液甲,则操作I为过滤,滤液甲中加入过量NaOH溶液操作II后得到沉淀B和滤液乙,操作II是过滤;Al2O3、SiO2能溶于强碱溶液而Fe2O3不溶于强碱溶液,SiO2不溶于稀盐酸而Fe2O3、Al2O3能溶于稀盐酸,根据图知,滤液甲中含有铝元素,则试剂a为稀盐酸,沉淀A为SiO2,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝。
(1)通过以上分析知,沉淀A SiO2,故答案为:SiO2 ;
(2)步骤②中加入过量NaOH溶液后,稀盐酸、铁离子、铝离子都和NaOH溶液反应,发生反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-,故答案为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-;
(3)步骤③中通入过量CO2气体而不加入过量盐酸的理由是过量的稀盐酸能溶解生成的氢氧化铝而得不到氢氧化铝,故答案为:过量盐酸能使生成的Al(OH)3溶解;
(4)根据图知,35-45mLNaOH溶液是溶解Al(OH)3,溶解Al(OH)3所需NaOH体积是生成Al(OH)3所需NaOH溶液体积的![]() ,所以生成Al(OH)3所需NaOH溶液体积为30mL,35mLNaOH溶液时铝离子、铁离子完全沉淀,则生成氢氧化铁沉淀所需NaOH溶液体积为5mL,
,所以生成Al(OH)3所需NaOH溶液体积为30mL,35mLNaOH溶液时铝离子、铁离子完全沉淀,则生成氢氧化铁沉淀所需NaOH溶液体积为5mL,
根据关系式Al2O3~2Al(OH)3~6NaOH知,n(Al2O3)= ![]() =0.05mol,m(Al2O3)=0.05mol×102g/mol=5.1g,氧化铝质量分数=
=0.05mol,m(Al2O3)=0.05mol×102g/mol=5.1g,氧化铝质量分数=![]() ×100%=63.75%,故答案为:63.75%。
×100%=63.75%,故答案为:63.75%。

