题目内容
有一放置在空气中的KOH固体,经测定,其中含 KOH 84.9%,KHCO3 5.1%,K2CO3 2.38%,H2O 7.62%。将此样品若干克投入 98克10%的盐酸中,待反应完全后,再需加入20克10%的KOH溶液方能恰好中和。求蒸发中和后的溶液可得固体多少克。
20克
分析:此题信息量大,所供数据多。根据有关化学反应方程式逐一分步求解,计算繁杂,失分率高。如果抛开那些纷繁的数据和局部细节,将溶液看成一个整体(化局部为整体),则无论是KOH、K2CO3还是KHCO3,与盐酸反应最终均生成KCl。由于KCl中的Cl—全部来自于盐酸,故可得关系式:
35.5→74.5
Cl—的质量=98×10%×(35.5÷36.5)=9.54克
设可得到固体(KCI)x克,则:
35.5 → 74.5
9.54 x
35.5:9.54=74.5:x
解之得x=20克
35.5→74.5
Cl—的质量=98×10%×(35.5÷36.5)=9.54克
设可得到固体(KCI)x克,则:
35.5 → 74.5
9.54 x
35.5:9.54=74.5:x
解之得x=20克

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
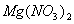 替代浓
替代浓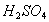 作为制取浓
作为制取浓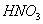 的脱水剂(以下数据均为质量百分比浓度)。65%
的脱水剂(以下数据均为质量百分比浓度)。65%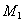 )中加72%
)中加72%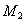 )后蒸馏,分别得到97.5%
)后蒸馏,分别得到97.5%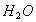 均无损耗,求蒸馏前的投料比
均无损耗,求蒸馏前的投料比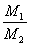 的值。
的值。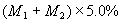 的
的