题目内容
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | |
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中[来源:Z*xx*k.Com]两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
(1)40 s (2分)
(2)黄色 前者弱(各2分)
(3)如图(3分,起点、终点各1分,斜率1分)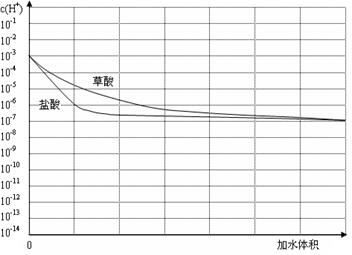
(4)MgCl2与(NH4)2C2O4恰好完全反应,但有
MgC2O4(s) Mg2+(aq)+C2O42-(aq),c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5,
Mg2+(aq)+C2O42-(aq),c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5,
而c(Mg2+)=c(C2O42-),
c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L
故Mg2+未沉淀完全。(4分)
(5)ABCD (3分,选对1个得1分,选对2个得2分,选对3个以上得3分)
解析

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目



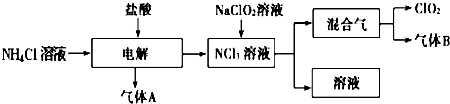
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.