题目内容
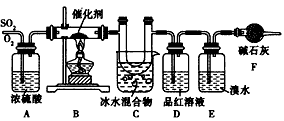
将SO2和O2按物质的量之比2∶1充入具有适宜反应条件的容积固定的密闭容器内,SO2跟O2发生可逆反应.试分析说明在一定的时间里SO2、O2和SO3的物质的量浓度以及正反应速率和逆反应速率是怎样变化的.
答案:
解析:
提示:
解析:
|
分析:
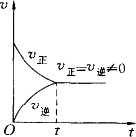
①在反应即将开始的一瞬间,SO2和O2的浓度处于最大状态,它们合成SO3的速率也处于最大状态,SO3的浓度为0,它分解为SO2和O2的速率也是0,如图所示. ②反应开始后,SO2和O2的物质的量浓度逐渐减小,正反应速率逐渐减小,SO3的物质的量浓度逐渐增大,逆反应速率逐渐增大,如图所示. ③随着时间的延长,SO2和O2的物质的量浓度继续减小,正反应速率继续减小,SO3的物质的量浓度继续增大,逆反应速率继续增大. ④由于化学反应是可逆的,SO2和O2的物质的量浓度不会无限度的减小,而是变为某一个值后保持不变,正反应速率也不会无限度的减小而是变为某一个值后保持不变;SO3的物质的量浓度不会无限度的增大,而是变为某一个值后保持不变,逆反应速率也不会无限度的增大,而是变为某一个值后保持不变. ⑤在可逆反应里,既然是SO2、O2和SO3的物质的量浓度都保持不变,必然是在相同的时间内SO2、O2的生成浓度和减小浓度相等,SO3的生成浓度和减小浓度相等,即正反应速率和逆反应速率相等. |
提示:
|
在一定条件下,可逆反应2SO2+O2 |

练习册系列答案
相关题目