题目内容
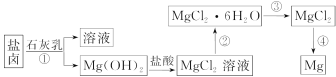
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是___ __ __ __ __ ___。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有__ ___ _溶液(填写化学式)的烧杯中,充分搅拌后经__ _ __ _ __、__ _ __ __ __(填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:

其中装置A的作用是___ ___ __ _ __ __ ___ __ __。
(4)写出过程④中发生反应的化学方程式___ __ __ __ __ ___。
(5)金属Mg在CO2中完全燃烧生成MgO和C,下列说法正确的是___ ___。
A.碳单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒半径:r(Mg2+) > r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
【答案】(1)石灰乳原料丰富,成本低;(2)MgCl2,过滤、洗涤;
(3)制备干燥的HCl气体;(4)MgCl2(熔融) ![]() Mg+Cl2↑;(5)C
Mg+Cl2↑;(5)C
【解析】
试题分析:(1)石灰乳可以用贝壳煅烧转化而成,因此原料丰富、价格低廉;
(2)Ca(OH)2微溶于水,Mg(OH)2难溶于水,目标产物是MgCl2,不能引入新杂质,因此加入MgCl2溶液,得到沉淀和溶液,采用过滤、洗涤、干燥得到纯净的Mg(OH)2;
(3)浓硫酸遇水放出热量,浓盐酸受热挥发,因此装置A的作用是产生干燥的HCl气体;
(4)反应④得到金属镁,工业上通常电解熔融状态下MgCl2得到镁,因此电解反应方程式为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(5)A、含有C60、C70等,故错误;B、Mg比Mg2+多一个电子层,因此r(Mg)>r(Mg2+),故错误;C、根据氧化还原反应的规律,强弱规律,即在此条件下Mg的还原性比C强,故正确;D、化学能除转化成热能,还能转化成光能,故错误。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】下列对一些实验事实的解释正确的是
选项 | 实验事实 | 解释 |
A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子,且苯与水互不相溶 |
D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |