题目内容
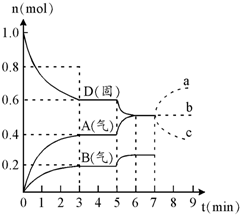 (2012?上海模拟)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
(2012?上海模拟)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
0.067
0.067
mol/L?min.(2)根据右图写出该反应的化学方程式
2D(s)?2A(g)+B(g)
2D(s)?2A(g)+B(g)
,该反应的平衡常数表达式为K=K=C2(A)×C(B)
K=C2(A)×C(B)
.(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是
吸热
吸热
(填“放热”或“吸热”)反应,反应的平衡常数增大
增大
(填“增大”、“减小”或“不变”.下同),B的反应速率增大
增大
.(4)若在第7分钟时增加D的物质的量,A的物质的量变化正确的是
b
b
(用图中a、b、c的编号回答)分析:(1)根据V=
进行计算;
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;温度升高化学反应速率加快;
(4)增加固体的物质的量,浓度不变,平衡不移动;
| △C |
| △t |
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;温度升高化学反应速率加快;
(4)增加固体的物质的量,浓度不变,平衡不移动;
解答:解:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
=0.067mol/L?min,
故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g);
故答案为:2D(s)?2A(g)+B(g)
因D为固体,所以化学平衡常数K=C2(A)×C(B),
故答案为:K=C2(A)×C(B);
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;
温度升高化学反应B的反应速率加快;
故答案为:吸热、增大、增大;
(4)D为固体,增加D的物质的量,浓度不变,平衡不移动,
故选:b;
| ||
| 3min |
故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g);
故答案为:2D(s)?2A(g)+B(g)
因D为固体,所以化学平衡常数K=C2(A)×C(B),
故答案为:K=C2(A)×C(B);
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;
温度升高化学反应B的反应速率加快;
故答案为:吸热、增大、增大;
(4)D为固体,增加D的物质的量,浓度不变,平衡不移动,
故选:b;
点评:本题主要考查了化学反应速率、平衡移动、平衡常数等概念,难度不大,根据所学知识即可完成.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 (2012?上海模拟)“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是( )
(2012?上海模拟)“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是( )