题目内容
密闭容器中的可逆反应3A?3B+C△H=+890kJ/mol,A的相对分子质量为120.随着温度升高,容器中气体平均相对分子质量减小,则下列判断正确的是( )
分析:该反应为吸热反应,随着温度升高,容器中气体平均相对分子质量减小,则平衡应正向移动,A、B、C均为气体,或A、B为气体,改变A的量,反应热不变,但反应吸收的热量变化,以此来解答.
解答:解:A.增加A的量,则△H的值不变,但吸收的热量增大,故A错误;
B.升高温度,平衡正向移动,相对分子质量减小,则A、B、C均为气体,或A、B为气体,C为固体或液体,故B错误;
C.若C为固体,则B一定是气体,平衡正向移动时,质量减小,物质的量不变,符合题意,故C正确;
D.若起始时往容器中投入18gA,n(A)=
=0.15mol,完全反应吸收热量为0.15mol×890kJ/mol×
=44.5kJ,但反应为可逆反应,所以吸收的热量小于44.5kJ,故D错误;
故选C.
B.升高温度,平衡正向移动,相对分子质量减小,则A、B、C均为气体,或A、B为气体,C为固体或液体,故B错误;
C.若C为固体,则B一定是气体,平衡正向移动时,质量减小,物质的量不变,符合题意,故C正确;
D.若起始时往容器中投入18gA,n(A)=
| 18g |
| 120g/mol |
| 1 |
| 3 |
故选C.
点评:本题考查化学平衡的移动,把握反应为吸热反应及温度对平衡的影响、平均相对分子质量减小为解答的关键,选项A为易错点,注意M=
分析平均相对分子质量变化,题目难度中等.
| m |
| n |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于密闭容器中的可逆反应:mX (g)+nY(s)?pZ (g);△H<0,达化学平衡后,改变条件,下列表述不正确的是( )
| A、增大压强,化学平衡不一定发生移动(m、p代表任意正整数) | B、通入氦气,化学平衡不一定发生移动 | C、增加X或Y的物质的量,化学平衡一定发生移动 | D、其它条件不变,升高温度,化学平衡一定发生移动 |
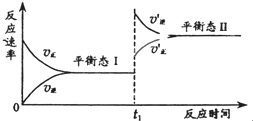 如图所示,一定条件下,某密闭容器中的可逆反应R(s)+X(g)﹦Y(g)+Z(g);△H>0达到平衡态I后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平衡态II.则t1时刻的条件改变可能是( )
如图所示,一定条件下,某密闭容器中的可逆反应R(s)+X(g)﹦Y(g)+Z(g);△H>0达到平衡态I后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平衡态II.则t1时刻的条件改变可能是( )| A、升高温度 | B、减小体积 | C、增大Y的浓度 | D、加入一定量的R |