题目内容
在一定温度下,将物质的量都为2mol的A和B充入一密闭容器中,发生如下反应:A(g)+2B(g)?2C(g)反应达到平衡时,C的物质的量为1.6mol,则此时A的转化率为( )
分析:A(g)+2B(g)?2C(g)
开始2 2 0
转化0.8 1.6 1.6
平衡1.2 0.4 1.6
以此计算A的转化率.
开始2 2 0
转化0.8 1.6 1.6
平衡1.2 0.4 1.6
以此计算A的转化率.
解答:解:将物质的量都为2mol的A和B充入一密闭容器中,发生A(g)+2B(g)?2C(g),
达到平衡时,C的物质的量为1.6mol,则
A(g)+2B(g)?2C(g)
开始2 2 0
转化0.8 1.6 1.6
平衡1.2 0.4 1.6
所以A的转化率为
×100%=40%,
故选B.
达到平衡时,C的物质的量为1.6mol,则
A(g)+2B(g)?2C(g)
开始2 2 0
转化0.8 1.6 1.6
平衡1.2 0.4 1.6
所以A的转化率为
| 0.8mol |
| 2mol |
故选B.
点评:本题考查化学平衡的计算,注意化学平衡三段法计算格式清晰直观,明确转化率的计算即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
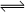 SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。 衡常数。
衡常数。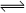 SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。