题目内容
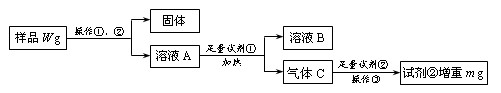
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
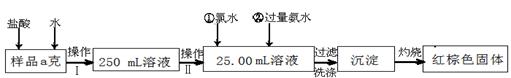
请根据上面流程,回答以下问题:
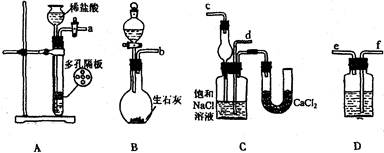
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作II 必须用到的仪器是 (从以下选项中选择,填编号)。
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是: 。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)

请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作II 必须用到的仪器是 (从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是: 。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
(共14分,每空2分)
(1)250mL容量瓶、胶头滴管; D
(2) 2Fe2+ + Cl2 =" " 3Fe3+ + 2Cl- ,Fe3+ +3 NH3·H2O = Fe (OH)3↓+ 3NH+4
(3)再次加热,并置于干燥器中冷却,称量,直至连续两次质量差不超过0.1g为止。
(4)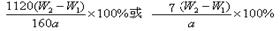
(5) 4Fe(OH)2+2H2O+O2=4Fe(OH)3
(1)250mL容量瓶、胶头滴管; D
(2) 2Fe2+ + Cl2 =" " 3Fe3+ + 2Cl- ,Fe3+ +3 NH3·H2O = Fe (OH)3↓+ 3NH+4
(3)再次加热,并置于干燥器中冷却,称量,直至连续两次质量差不超过0.1g为止。
(4)
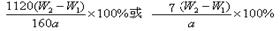
(5) 4Fe(OH)2+2H2O+O2=4Fe(OH)3
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。 
 骤,请排出正确的操作顺序:
骤,请排出正确的操作顺序: