题目内容
(1)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为
(2)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2 的物质的量之比为
2:1
2:1
,含1mol Cl-的该混合物的质量是65
65
g(2)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2 的物质的量之比为
2:1
2:1
.分析:(1)由化学式可知,n(K+)=n(KCl),n(Ca2+)=n(CaCl2),则n(KCl):n(CaCl2)=n(K+):n(Ca2+);
令氯化钙的物质的量为xmol,用x表示出氯化钾的物质的量,进而表示出氯离子的物质的量,据此计算x的值,再根据m=nM计算;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程计算x、y的值,据此解答.
令氯化钙的物质的量为xmol,用x表示出氯化钾的物质的量,进而表示出氯离子的物质的量,据此计算x的值,再根据m=nM计算;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程计算x、y的值,据此解答.
解答:解:(1)由化学式可知,n(K+)=n(KCl),n(Ca2+)=n(CaCl2),则n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1;
令氯化钙的物质的量为xmol,则氯化钾的物质的量为2xmol,则2x+2x=1,解x=0.25,故混合物的总质量=0.25mol×111g/mol+0.25mol×2×74.5g/mol=65g,
故答案为:2:1;65g;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程,则:
,解得x=0.04,y=0.02,
故CO和CO2 的物质的量之比为0.04mol:0.02mol=2:1,
故答案为:2:1.
令氯化钙的物质的量为xmol,则氯化钾的物质的量为2xmol,则2x+2x=1,解x=0.25,故混合物的总质量=0.25mol×111g/mol+0.25mol×2×74.5g/mol=65g,
故答案为:2:1;65g;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程,则:
|
故CO和CO2 的物质的量之比为0.04mol:0.02mol=2:1,
故答案为:2:1.
点评:本题考查混合物的有关计算,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
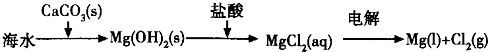
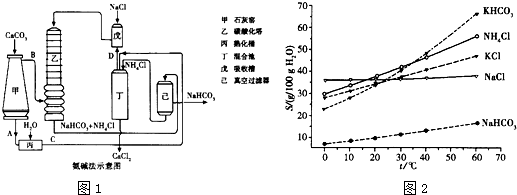
 (2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
(2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.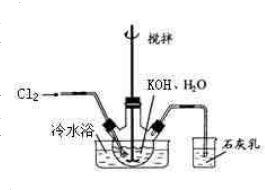 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液. 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O,