��Ŀ����
����Ŀ��0.80g CuSO45H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ��
��ش��������⣺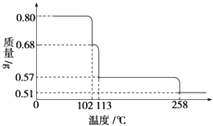
��1����ȷ��200��ʱ�������ʵĻ�ѧʽ ��
��2��ȡ270��������Ʒ����570�����յõ�����Ҫ�����Ǻ�ɫ��ĩ��һ�����������壬�÷�Ӧ�Ļ�ѧ����ʽΪ���Ѹú�ɫ��ĩ�ܽ���ϡ�����У���Ũ������ȴ���о����������þ���Ļ�ѧʽΪ �� ����ڵ�����¶���
��3������������������ˮ��Ӧ����һ�ֻ�����û������Ũ��Һ��Cu�ڼ���ʱ������Ӧ�Ļ�ѧ����ʽΪ
���𰸡�
��1��CuSO4?H2O
��2��CuSO4 ![]() CuO+SO3����CuSO4?5H2O��102��
CuO+SO3����CuSO4?5H2O��102��
��3��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
���������⣺��1��CuSO45H2O���ȵ�102��ʱ��ʼ��ˮ�ֽ⣬113��ʱ�ɵõ����ȶ���һ���м����258��ʱ�Ż�����ֽ⣮��200��ʱʧȥ��ˮ������Ϊ0.80g��0.57g=0.23g�����ݷ�Ӧ�Ļ�ѧ����ʽ��
CuSO45H2O |
| CuSO4��5��n��H2O+ | nH2O |
250 | 18n | ||
0.80g | 0.80g��0.57g=0.23g |
![]() �����n=4��
�����n=4��
200��ʱ�ù������ʵĻ�ѧʽΪCuSO4H2O���ʴ�ΪCuSO4H2O����2���¶�Ϊ570�����յõ��ĺ�ɫ��ĩӦ��CuO��������������ΪSO3 �� ��Ӧ����ʽΪ��CuSO4 ![]() CuO+SO3����CuO��ϡ���ᷴӦ�IJ���������ͭ��ˮ��
CuO+SO3����CuO��ϡ���ᷴӦ�IJ���������ͭ��ˮ��
����Ũ������ȴ�õ��ľ���ΪCuSO45H2O������ڵ����102�森�ʴ�Ϊ��CuSO4 ![]() CuO+SO3���� CuSO45H2O��102�棻��3��SO3��ˮ��Ӧ�������ᣬŨ������ͭ���ȷ�Ӧ�Ļ�ѧ����ʽΪ��2H2SO4��Ũ��+Cu
CuO+SO3���� CuSO45H2O��102�棻��3��SO3��ˮ��Ӧ�������ᣬŨ������ͭ���ȷ�Ӧ�Ļ�ѧ����ʽΪ��2H2SO4��Ũ��+Cu ![]() CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��1����ͼ������֪��CuSO45H2O���ȵ�102��ʱ��ʼ��ˮ�ֽ⣬113��ʱ�ɵõ����ȶ���һ���м����258��ʱ�Ż�����ֽ⣻��200��ʱʧȥ��ˮ������Ϊ0.80g��0.57g=0.23g��������Ӧ�Ļ�ѧ����ʽ����ȷ����ʱ�������ʵĻ�ѧʽ����2���¶�Ϊ570�����յõ��ĺ�ɫ��ĩ��CuO��������������ΪSO3 �� ��Ӧ����ʽΪ��CuSO4 ![]() CuO+SO3����CuO��ϡ���ᷴӦ�IJ���������ͭ��ˮ������Ũ������ȴ�õ��ľ���ΪCuSO45H2O������ͼ���������ڵ����102�棻��3������Ũ�������ǿ�����Խ��з�����д���йصĻ�ѧ����ʽ��
CuO+SO3����CuO��ϡ���ᷴӦ�IJ���������ͭ��ˮ������Ũ������ȴ�õ��ľ���ΪCuSO45H2O������ͼ���������ڵ����102�棻��3������Ũ�������ǿ�����Խ��з�����д���йصĻ�ѧ����ʽ��

����Ŀ��ͨ�����ǰѲ�1molij��ѧ�������յ��������ɸû�ѧ���ļ��ܣ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ķ�Ӧ�ȵ��ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJmol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
��ش��������⣺
��1����֪Si��SiC��SiO2�ۻ�ʱ�������������ѧ�����Ƚ������������ʵ��۵�ߵͣ��������������SiCSi��SiSiO2
��2����ҵ�ϸߴ����ͨ�����з�Ӧ��ȡ��
SiCl4��g��+2H2��g�� ![]() Si��s��+4HCl��g����
Si��s��+4HCl��g����
��2mol H2���ɸߴ�����������ա��ų���������kJ��