题目内容
先求样品中各组成元素的质量分数和实验式,再由相对分子质量求分子式。
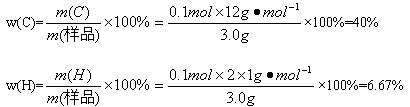
因为C、H元素的质量分数之和小于1,所以必含氧元素。
w(O)=100%-40%-6.67%=53.33%
![]()
所以实验式为CH2O。因Mr=60,所以(CH2O)n=60,n=2,有机物分子式为C2H4O2,因C2H4O2+2O2![]() 2CO2+2H2O。
2CO2+2H2O。
通入氧气总体积为:
![]()
解析:由于剩余气体可用于抢救危重病人,可知剩余气体为O2,因此有机物完全燃烧。浓H2SO4质量增加是由于吸收水蒸气的结果,所以m(H2O)=![]() =0.1 mol,则n(CO2)=0.1 mol。有机物的相对分子质量为15×4=60。先判断有机物的组成元素,根据质量守恒定律,如果CO2和H2O中,C、H质量之和等于
=0.1 mol,则n(CO2)=0.1 mol。有机物的相对分子质量为15×4=60。先判断有机物的组成元素,根据质量守恒定律,如果CO2和H2O中,C、H质量之和等于
![]()

练习册系列答案
相关题目
