题目内容
【题目】(1)乙酸的沸点明显高于乙醛的主要原因是________________。
(2)已知元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,元素Y基态原子的3p轨道上有4个电子,元素Z的最外层电子数是其内层的3倍。
则①与YZ![]() 互为等电子体的分子的化学式________(任写一种)。
互为等电子体的分子的化学式________(任写一种)。
②X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
③Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是__________________。
(3)已知苯酚( )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是______________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是______________________。
【答案】(1)CH3COOH存在分子间氢键
(2)①CCl4或SiCl4等
②16NA或16×6.02×1023个
③水分子与乙醇分子之间存在氢键
(3)< 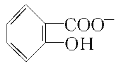 中形成分子内氢键,使其更难电离出H+
中形成分子内氢键,使其更难电离出H+
【解析】(1)因乙酸分子间能形成氢键,故乙酸的沸点明显比乙醛高。(2)①SO![]() 中S原子采取sp3杂化,SO
中S原子采取sp3杂化,SO![]() 空间构型为正四面体。与SO
空间构型为正四面体。与SO![]() 互为等电子体的分子有SiCl4或CCl4等。在[Zn(NH3)4]Cl2中每个NH3分子中的3个N—H键均为σ键,中心离子Zn2+与4个NH3分子结合的配位键也为σ键。故1 mol配合物中的σ键数目为4+3×4=16(mol)即16NA个σ键。Z为氧元素,H2O在乙醇中的溶解度大于H2S,是因为水分子与乙醇分子间形成氢键,而H2S不能。
互为等电子体的分子有SiCl4或CCl4等。在[Zn(NH3)4]Cl2中每个NH3分子中的3个N—H键均为σ键,中心离子Zn2+与4个NH3分子结合的配位键也为σ键。故1 mol配合物中的σ键数目为4+3×4=16(mol)即16NA个σ键。Z为氧元素,H2O在乙醇中的溶解度大于H2S,是因为水分子与乙醇分子间形成氢键,而H2S不能。

练习册系列答案
相关题目