题目内容
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3 Y 2 Z,其平衡常数为1600
2 Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
| 物质 | X | Y | Z |
| 初始浓度/mol·L—1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L—1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3 Y
 2 Z,其平衡常数为1600
2 Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
C
反应达平衡时,X的转化率为0.05÷0.1=0.5,即50%,选项A正确;根据表中数据可知,平衡时X的浓度减少0.05mol/L,Y的浓度减少0.15mol/L,而Z的浓度增加0.1mol/L,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的方程式是X(g) + 3Y(g) 2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是
2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是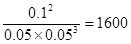 ,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
 2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是
2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是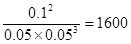 ,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白: 2NH3(g);△H<0
2NH3(g);△H<0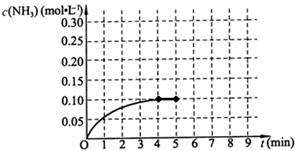
 2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol?L-1, c(B2)=0.1mol?L-1,c(C)=1.6mol?L-1。若A2、B2、C的起始浓度分别为a mol?L-1、b mol?L-1、g mol?L-1请确定:
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol?L-1, c(B2)=0.1mol?L-1,c(C)=1.6mol?L-1。若A2、B2、C的起始浓度分别为a mol?L-1、b mol?L-1、g mol?L-1请确定: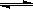 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是 HCl+HClO。加入少量下列物质能使c(HClO)增大
HCl+HClO。加入少量下列物质能使c(HClO)增大 ?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小
?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小 ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大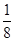 ,则方程式中a值是
,则方程式中a值是 PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( ) 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)