题目内容
4.设NA为阿伏加德罗常数,下列说法错误的是( )| A. | 22.4L O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5NA | |
| C. | 18g H2O含有的H2O分子数目为NA | |
| D. | 0.5 NA个氯气分子的物质的量是0.5mol |
分析 A、氧气所处的状态不明确;
B、水中含3个原子;
C、根据分子个数N=$\frac{m}{M}{N}_{A}$来计算;
D、根据物质的量n=$\frac{N}{{N}_{A}}$来计算.
解答 解:A、氧气所处的状态不明确,故无法计算其物质的量和原子数目,故A错误;
B、水中含3个原子,即1mol水中含3mol原子,故0.5mol水中含1.5mol原子即1.5NA个,故B正确;
C、10g水中含有的分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{18g}{18g/mol}{N}_{A}$=NA,故C正确;
D、氯气的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.恒容下的2SO2+O2 ?2SO3;△H<0,达到平衡后,下列可以加快反应速率的方法是( )
| A. | 将SO3分离出一部分 | B. | 升温 | ||
| C. | 充入少量N2,增大压强 | D. | 充入少量SO3气体 |
9.有①KOH ②BaCl2 ③FeCl3 ④NaCl ⑤MgSO4五种溶液,不用其他任何试剂,只用先鉴别出来的物质去确定剩余物质,则它们被鉴别出来的顺序是( )
| A. | ③①②④⑤ | B. | ③①⑤②④ | C. | ③⑤②①④ | D. | ③①②⑤④ |
13.只用胶头滴管和试管通过两试剂的互滴,不能区别的下列溶液(浓度均为0.1mol/L)( )
| A. | NaAlO2和稀盐酸 | B. | NaHCO3和Ca(OH)2 | C. | NaOH和Al2(SO4)3 | D. | HCl和Na2CO3 |
14.在容量瓶上标记有的是( )
| A. | 压强 | B. | 温度 | C. | 浓度 | D. | 容量 |
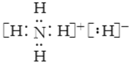 ,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3.
,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3. H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1.
H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1.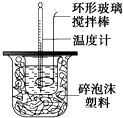 在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.
在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.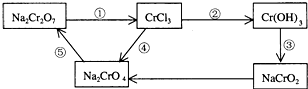 化学实验中,如果使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.
化学实验中,如果使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质. 反应3A(g)+2B(g)?xC(g)+2D(g)过程中的能量变化如图所示,回答下列问题.
反应3A(g)+2B(g)?xC(g)+2D(g)过程中的能量变化如图所示,回答下列问题.