题目内容
CO和CO2都可以合成甲醇:CO+2H2→CH3OH;CO2+3H2→CH3OH+H2O,CO、CO2和H2可通过下列反应制备:
①CH4+H2O(g)→CO+3H2;
②CO+H2O(g)→CO2+H2;
反应①的产物合成甲醇时H2过量,反应②的产物合成甲醇时H2不足.为了充分利用原料,可将两个反应的产物混合使用.
(1)反应①和反应②的产物气体混合的最佳比例为______.
(2)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体用于合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为______.
(3)若以100LCH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,则在相同条件下反应后的气体的体积为______.(写出范围).
①CH4+H2O(g)→CO+3H2;
②CO+H2O(g)→CO2+H2;
反应①的产物合成甲醇时H2过量,反应②的产物合成甲醇时H2不足.为了充分利用原料,可将两个反应的产物混合使用.
(1)反应①和反应②的产物气体混合的最佳比例为______.
(2)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体用于合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为______.
(3)若以100LCH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,则在相同条件下反应后的气体的体积为______.(写出范围).
(1)设反应①的气体产物共为V1L,则合成甲醇时H2过量0.25V1L,反应②的气体产物共为V2L,则反应②生成的气体中CO2体积为0.5V2L,H2的体积为0.5V2L,反应CO+2H2→CH3OH合成甲醇剩余的氢气,与反应②生成的混合气体恰好发生反应CO2+3H2→CH3OH+H2O,
故0.5V2L:(0.5V2L+0.25V1L)=1:3,整理得V1:V2=4:1,
故答案为:4:1;
(2)使原子利用率都达到100%,根据原子守恒,由甲醇的分子式可知,则混合气体中n(C):n(H):n(O)=1:4:1,
令CH4、CO、H2O的物质的量分别为xmol、ymol、zmol,则(x+y):(4x+2z):(y+z)=1:4:1,
整理得x:y:z=2:1:2,
故答案为:2:1:2;
(3)假定只发生反应CH4+H2O (g)→CO+3H2,生成的混合气体的体积最大,最大体积为100L×
=200L,假定只发生CH4+2H2O(g)→CO2+4H2,生成的混合气体的体积最小,最小体积为100L×
=166.7L,故反应后气体的体积为:166.7L<v<200L,
故答案为:166.7L<V<200L.
故0.5V2L:(0.5V2L+0.25V1L)=1:3,整理得V1:V2=4:1,
故答案为:4:1;
(2)使原子利用率都达到100%,根据原子守恒,由甲醇的分子式可知,则混合气体中n(C):n(H):n(O)=1:4:1,
令CH4、CO、H2O的物质的量分别为xmol、ymol、zmol,则(x+y):(4x+2z):(y+z)=1:4:1,
整理得x:y:z=2:1:2,
故答案为:2:1:2;
(3)假定只发生反应CH4+H2O (g)→CO+3H2,生成的混合气体的体积最大,最大体积为100L×
| 4 |
| 2 |
| 5 |
| 3 |
故答案为:166.7L<V<200L.

练习册系列答案
相关题目





 广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
 ,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上3~5天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定(
,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上3~5天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定( ).下列说法不正确的是( )
).下列说法不正确的是( )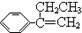 在光照条件下与Cl2通过取代反应制得纯度较高的稗草烯
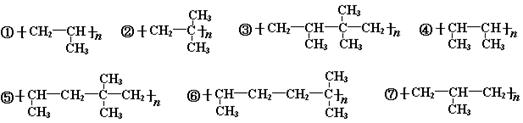
在光照条件下与Cl2通过取代反应制得纯度较高的稗草烯 ,它们混合在一起,在一定条件下进行加聚反应,其中产物可能有(
,它们混合在一起,在一定条件下进行加聚反应,其中产物可能有(  )
)