��Ŀ����
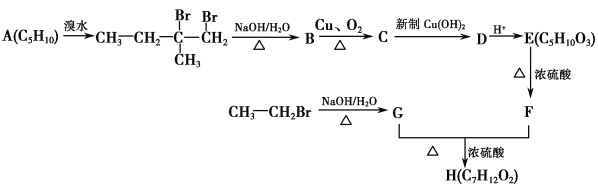
����Ŀ���ҹ��涨�����ڼ�ȩ�������ó���0.08mgm��3��ij�о���ѧϰС������������KMnO4��Һ�ⶨ�����м�ȩ�ĺ���������Э������������ѧϰ������װ����ͼ�����䷴Ӧԭ�����������£�
4MnO4��+5HCHO+H+�TMn2++5CO2��+11H2O
2MnO4��+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O
���裺����ȡ5.00mL 1.00��10��3molL��1 KMnO4����Һ��ϴ��ƿ�У������뼸��ϡH2SO4����ˮ20mLϡ�ͱ�����
��ȡ1.00��10��3molL��1�������Һ����ʽ�ζ����б�����
����ע������ȡ100mL��װ�����ڿ������ٽ�ע������������ϴ��ƿ�г�ַ�Ӧ�����ظ�4����
�ܽ�ϴ��ƿ����Һת�Ƶ���ƿ�У�����ϴ��Һ�������ñ�������Һ���еζ�����¼�ζ������ĵIJ�����Һ�������
�����ظ�ʵ��2�Σ�ÿ��ȡ���������Һ5.00mL����3��ʵ�����IJ�����Һ�����ƽ��ֵΪ12.38mL��
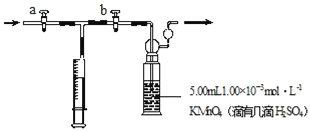
�ش���������
��1��5.00mL���������_____��ȡ��
��2����ʵ����ָʾ��_____������ĸ����
a���ȡ�b��̪��c���ۡ�d�������������Լ�
��3������þ����ڿ����м�ȩ��Ũ��_____mgm��3��
��4�����в������������ڼ�ȩŨ��ƫ�ߵ���_____��
a���ζ��յ㸩�Ӷ���
b���ζ�ǰ�����ݵζ���������
c���ڸ��������Һ�м�������ˮ
d��װ����ĵζ���δ��ϴ
��5�������Ƕ�Ԫ��ǿ�ᣬ����������Һ�����ԣ������£������10 mL 0.01molL��1H2C2O4��Һ�еμ�0.01 molL��1NaOH��Һ
�ٵ������NaOH��Һ���Ϊ10mL������д����Һ�������غ��ϵʽ_____��
�ڵ������NaOH��Һ���Ϊ20mL������д����Һ�����ӵ�Ũ�ȴ�С��ϵ_____��
���𰸡� ��ʽ�ζ��� d 18 a c��H+��+c��H2C2O4��=c��OH����+c��C2O42���� c��Na+����c��C2O42������c��OH������c��HC2O4������c��H+��
����������1�����⿼��ζ�ʵ�飬ע��ζ���ѡȡ�����ķ����� ���������Һ����ǿ�����ԣ���ʽ�ζ����¶���һ����������ض����и�ʴ�ԣ���˸������ʢ������ʽ�ζ����У���2�����������Һ��������ɫ����˲���Ҫָʾ������ѡ��d��ȷ����3���������ӷ�Ӧ����ʽ������ᷴӦ�ĸ�����ص����ʵ���Ϊ12.38��10��3��1��10��3��2/5mol=4.952��10��6mol�����ݸ���������ȩ��Ӧ�����ӷ�Ӧ����ʽ�����ļ�ȩ�����ʵ���Ϊ��5��10��3��1��10��3��4.952��10��6����5/4mol=6��10��8mol��������Ϣ������ȡ����500ml����˼�ȩ��Ũ��Ϊ6��10��8��30��103/500��10��6mg/m3=3.6 mg/m3����4��a���ζ�ʱ���Ӷ��������IJ���������С�������ȩ��Ӧ�ĸ�����ص������ӣ������ļ�ȩ��Ũ��ƫ�ߣ�����ȷ��b���ζ�ǰ�����ݵζ��������ݣ����IJ����������ӣ����ȩ��Ӧ�ĸ�����ص�����С�������ļ�ȩ��Ũ��ƫ�ͣ��ʴ���c�����������Һ��ˮ��������ص����ʵ������䣬���ȩ��Ũ�Ȳ��䣬�ʴ���d��ʢװ����ĵζ���Ϊ��ϴ�������Ũ��ƫС�����IJ��������������ȩ��Ӧ�ĸ�����ص�����С����ļ�ȩ��Ũ��ƫ�ͣ��ʴ���5�����⿼������Ũ�ȴ�С�ıȽϣ���������ʵ��������ˮ���ص����֣�һ���֣�������������NaOH10mL����Һ������ΪNaHC2O4�������غ㣺c(Na��)=c(HC2O4��)��c(C2O42��)��c(H2C2O4) ������غ㣺c(Na��)��c(H��)=c(HC2O4��)��c(OH��)��2c(C2O42��)����������غ�Ϊ�� c(H��)+ c(H2C2O4)= c(OH��)+ c(C2O42��) ����������NaOH�����Ϊ20mLʱ����Һ������ΪNa2C2O4��C2O42������ˮ�⣺C2O42����H2O ![]() HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O
HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O ![]() H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��
H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��