题目内容
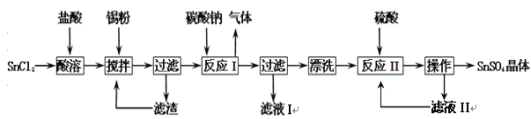
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
【答案】(1)抑制SnCl2水解 (2)Sn2++CO32-═SnO↓+CO2↑
(3)取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
(4)蒸发浓缩、冷却结晶;
(5)6Fe2++Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O 90%
【解析】
试题分析:(1)SnCl2在水中发生水解反应:SnCl2+H2O═Sn(OH)Cl+HCl(可逆反应,应该用可逆号),生成难溶物Sn(OH)Cl,溶液含有杂质,若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解;
(2)反应Ⅰ为向SnCl2溶液中加碳酸钠,得到的沉淀为SnO,反应离子方程式为Sn2++CO32-═SnO↓+CO2↑;
(3)沉淀SnO的表面附着液中含有氯离子,反复洗涤后,取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,即可证明洗涤干净;
(4)通过蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥即可从反应II后的溶液中获得SnSO4晶体;
(5)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,其中酸性K2Cr2O7溶液氧化Fe2+的离子方程式为6Fe2++Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O;
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.200mol/L×0.015L
故(3×119g):(1.19g×x)=1mol:(0.200mol/L×0.015L)
解得x=90%。

 阅读快车系列答案
阅读快车系列答案