题目内容
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,22.4L空气中含单质气体的分子数为NA | |
| B. | 1L0.5mol•L-1FeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶体 | |
| C. | NA个N2分子所占的体积与0.5NA个H2分子所占的体枳比为2:1 | |
| D. | 2.3gNa完全与O2反应生成Na2O,失去的电子数为0.1NA |
分析 A、空气中不但含单质气体,也含气体化合物;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、氮气和氢气所处的状态不明确;
D、求出钠的物质的量,然后根据钠反应后变为+1价来分析.
解答 解:A、空气中不但含单质气体,也含气体化合物,故标况下22.4L空气即1mol空气中含有的单质气体的分子个数小于NA个,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的氢氧化铁胶粒的个数小于0.5NA个,故B错误;
C、氮气和氢气所处的状态不明确,故两者所占的体积不一定是2:1,故C错误;
D、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠转移0.1NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼分子空间上是三角锥形 | |
| C. | 氯化硼熔点低是因为硼氯键键能较小 | |
| D. | 氯化硼属非极性分子 |
1.多原子分子氰[(CN)2]、硫氰[(SCN)2]和(OCN)2的性质与卤素单质相似,故称它们为类卤素,它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I).
(1)在表中①、②、③的空格处应填写的名称或化学式分别是氧氰、HSCN、KOCN.
(2)完成下列反应的化学方程式或离子方程式.
①(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O.
②已知阴离子的还原性:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2时发生反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
(2)完成下列反应的化学方程式或离子方程式.
①(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O.
②已知阴离子的还原性:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2时发生反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
15.下列实验能达到实验目的且符合实验设计要求的是( )
| A. |  测定反应生成氢气的速率 | B. |  模拟海水中铁打的防护 | ||
| C. |  证明碳酸氢钠热稳定性差 | D. |  制备乙酸甲酯 |
2.在下列溶液中分别通入足量的CO2,最终产生沉淀的是( )
| A. | 氯化钙 | B. | 氢氧化钙 | C. | 氯化钠 | D. | 偏铝酸钠 |
19.下列有关化学用语表示正确的是( )
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 18O2-的结构示意图: | ||
| C. | 羟基的电子式: | D. | 淀粉和纤维素的结构简式:CH2O |
20.有机物的结构可用“键线式”表示.如CH3-CH═CH-CH3,可简写为 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为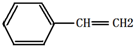 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
 .
.