题目内容
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝片与稀盐酸的反应 | B.Ba(OH)2?8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在氧气中的燃烧反应 |
C
解析试题分析:凡是有元素化合价升降的反应是氧化还原反应,如果反应前的总能量高于生物的总能量,反应就是放热反应,反之是吸热反应。A、是氧化还原反应,但属于放热反应,A不正确;B、属于吸热反应,但不是氧化还原反应,B不正确;C、是氧化还原反应,同时还是吸热反应,C正确;D、甲烷在氧气中燃烧是氧化还原反应,但属于放热反应,D不正确,答案选C。
考点:考查氧化还原反应与放热反应和吸热反应的判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:
(1)Fe2O3(s) + C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+ O2(g)=Fe2O3(s) 的ΔH是( )
O2(g)=Fe2O3(s) 的ΔH是( )
| A.-824.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示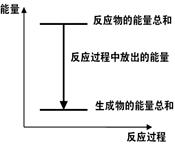 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
CO(g)+H2O(g) H2(g)+CO2(g)<0,在其他条件不变的情况下:
H2(g)+CO2(g)<0,在其他条件不变的情况下:
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O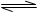 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
下列图示与对应的叙述相符的是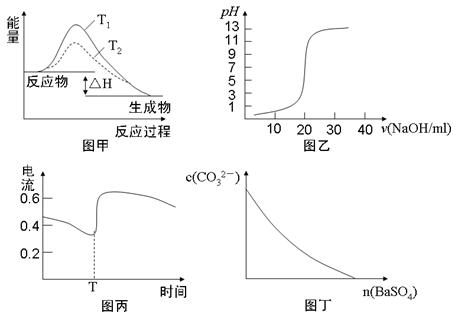
| A.图甲表示T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
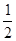 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2  2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是