题目内容
| A、离子键的本质是静电作用,阴阳离子电荷越大、离子半径越小,静电作用越强 | B、共价键的本质是共用电子对,因此必须由成键的两原子各提供一个电子形成 | C、分子晶体的基本微粒是分子,分子晶体熔沸点由分子内部共价键强弱决定 | D、原子晶体由于是空间网状结构,因此只能由碳、硅两元素构成 |
B.共价键的本质是共用电子对,是由成键原子提供的;
C.分子晶体的熔沸点由分子间作用力决定;
D.原子晶体是空间网状结构.
B.共价键的本质是共用电子对,是由成键原子提供的,但成键原子不一定提供一个电子,如氮气分子中每个氮原子提供3个电子,故B错误;
C.分子晶体的基本微粒是分子,分子晶体熔沸点由分子间作用力决定,与分子内部共价键强弱无关,故C错误;
D.原子晶体是空间网状结构,如二氧化硅是原子晶体,是由氧元素和硅元素组成的,故D错误;
故选A.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案(化学-物质结构与性质)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),
其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。

A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
(6)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
若有1mol CH4生成,则有 molσ键和 molπ键断裂。
回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)已知:波长为300nm的紫外光的光子所具有的
能量约为39 9 kJ/mol。
根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________________________________________________
_____________________________________________________________。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中含有极性键的数目是___________ ;NH4+的空间构型是_______________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该 反应中有8mol N-H键断裂,则形成的π键有________mol。
(4)硼砂是含结晶水的四硼酸钠,其阴离子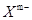 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:

①在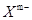 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由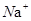 、
、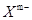 和
和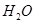 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。
A.共价键 B.离子键 C. 氢键 D.范德华力 E. 金属键
(8分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长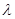 与光的频率v的关系为
与光的频率v的关系为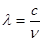 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
。(未说明原因不给分)
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。
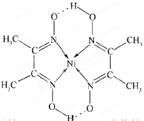
A.离子键 B.共价键 C.配位键 D.氢键
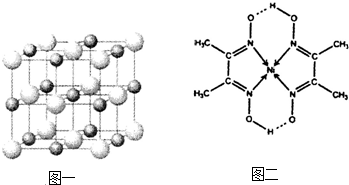 (3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表: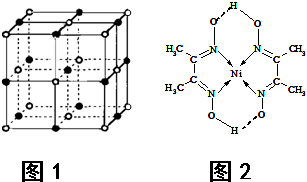 (2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.