题目内容
有一无色透明澄清溶液,可能含有较大量的Cu2+、Ba2+、SO、NO、I-、S2-、H+、K+等离子中两种或多种,做如下实验:
①取溶液少量加入铁粉有气体放出;
②另取原溶液加Na2SO3溶液后有气体放出,也有白色沉淀生成,再加盐酸沉淀不完全消失;
③另取原溶液加入AgNO3溶液无沉淀生成。
(1)由此判断原溶液中一定含有的离子是________,一定不含有的离子是________,可能含有的离子是________;
(2)有关反应①的离子方程式为________。
:H+、Ba2+、NO Cu2+、SO、I-、S2- K+ 3Fe+2NO3-+8H+===3Fe2++2NO+4H2O
根据原溶液无色,可排除Cu2+的存在;由③知原溶液中无SO、I-(均可与Ag+生成沉淀);由②知原溶液加入Na2SO3溶液也白色沉淀(不溶于盐酸,说明是BaSO4)生成,说明有NO、H+、Ba2+,排除还原性离子S2-的存在:
3SO32-+2NO3-+2H+=3SO42-+2NO↑+H2O、Ba2++SO42-=BaSO4↓。
同时验证了①加入铁粉也有气体放出:3Fe+2NO3-+8H+===3Fe2++2NO+4H2O
但最终K+不能确定是否存在。
根据原溶液无色,可排除Cu2+的存在;由③知原溶液中无SO、I-(均可与Ag+生成沉淀);由②知原溶液加入Na2SO3溶液也白色沉淀(不溶于盐酸,说明是BaSO4)生成,说明有NO、H+、Ba2+,排除还原性离子S2-的存在:
3SO32-+2NO3-+2H+=3SO42-+2NO↑+H2O、Ba2++SO42-=BaSO4↓。
同时验证了①加入铁粉也有气体放出:3Fe+2NO3-+8H+===3Fe2++2NO+4H2O
但最终K+不能确定是否存在。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
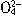 、N
、N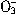 、I-、S2-、H+、K+等离子中的两种或多种。进行如下实验:①取少量溶液并加入铁粉有气体放出。②另取原溶液加入Na2SO3溶液后也有气体放出,且有白色沉淀生成,再加盐酸沉淀不完全消失。③另取原溶液加入AgNO3溶液无沉淀生成。由此判断:(1)原溶液中一定含有的离子是__________________;(2)一定不含的离子是________________;(3)可能含有的离子是______________。
、I-、S2-、H+、K+等离子中的两种或多种。进行如下实验:①取少量溶液并加入铁粉有气体放出。②另取原溶液加入Na2SO3溶液后也有气体放出,且有白色沉淀生成,再加盐酸沉淀不完全消失。③另取原溶液加入AgNO3溶液无沉淀生成。由此判断:(1)原溶液中一定含有的离子是__________________;(2)一定不含的离子是________________;(3)可能含有的离子是______________。