题目内容
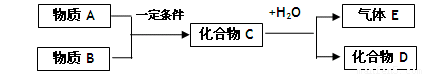
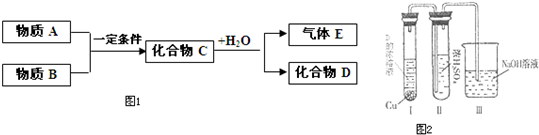
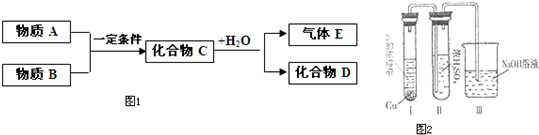
短周期元素形成的纯净物A、B、C、D、E之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式______.
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),D是既能溶于强酸、又能溶于强碱的化合物.
用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系______.
(3)若C是一种红棕色气体,D是一种强酸,则:
①C与水反应的化学方程式为______.
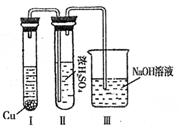
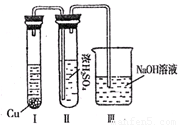
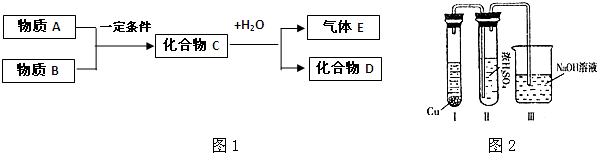
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用右图装置进行实验(反应前Ⅰ、Ⅱ装置中空气已排尽).实验进行一段时间后,浓H2SO4中未发现有气体逸出,且该溶液变为红棕色,则你得出的结论是______.
③已知A与物质B及水作用生成D,写出此反应的化学方程式______.
解:(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2,故答案为:Na2O2(NaH);
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),应为H2S,D是既能溶于强酸、又能溶于强碱的化合物,应为Al(OH)3,则C为Al2S3,
E与NaOH溶液反应后生成正盐为Na2S,溶液中存在电荷守恒,为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),
故答案为:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-);
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,
①NO2与水反应生成HNO3和NO,反应的方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
③A和B的反应应为NO和O2的反应,在溶液中发生4NO+3O2+2H2O=4HNO3,
故答案为:4NO+3O2+2H2O=4HNO3.
分析:(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2;
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),应为H2S,D是既能溶于强酸、又能溶于强碱的化合物,应为Al(OH)3,则C为Al2S3;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题.
点评:本题考查无机物的推断,以物质的性质为载体综合考查物质的性质探究以及离子浓度的大小比较,题目难度中等,明确物质的种类为解答该题的关键.
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),应为H2S,D是既能溶于强酸、又能溶于强碱的化合物,应为Al(OH)3,则C为Al2S3,
E与NaOH溶液反应后生成正盐为Na2S,溶液中存在电荷守恒,为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),
故答案为:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-);
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,
①NO2与水反应生成HNO3和NO,反应的方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
③A和B的反应应为NO和O2的反应,在溶液中发生4NO+3O2+2H2O=4HNO3,
故答案为:4NO+3O2+2H2O=4HNO3.
分析:(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2;
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),应为H2S,D是既能溶于强酸、又能溶于强碱的化合物,应为Al(OH)3,则C为Al2S3;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题.
点评:本题考查无机物的推断,以物质的性质为载体综合考查物质的性质探究以及离子浓度的大小比较,题目难度中等,明确物质的种类为解答该题的关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目

 种化学式 。
种化学式 。