题目内容
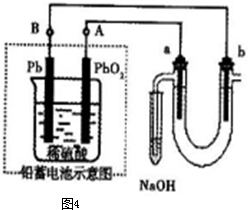
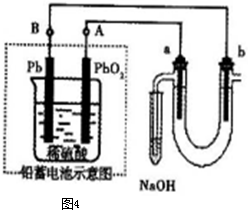
关于铅蓄电池的说法正确的是( )
| A、充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq) | B、充电时,电池中硫酸的浓度不断变小 | C、放电时该电池的负极材料是铅版 | D、放电时正极发生的反应是:Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
分析:铅蓄电池放电时,正极上电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l),负极上电极反应式为:Pb(s)+SO42-(aq)-2e-═PbSO4(s),充电时,阴、阳极上的电极反应式与负极、正极上电极反应式正好相反,据此分析解答.
解答:解:A、充电时,阳极上发生失电子的氧化反应,该电极的电极反应式与正极上电极反应式正好相反,PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq),故A错误;
B、充电时,电池反应为:2PbSO4(s)+2H2O(l)?Pb(s)+PbO2(s)+2H2SO4(aq),电池中硫酸的浓度不断变大,故B错误;
C、放电时该电池的负极材料是铅,负极上电极反应式为:Pb(s)+SO42-(aq)-2e-═PbSO4(s),故C正确;
D、放电时正极发生得电子的还原反应,电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l),故D错误.
故选C.
B、充电时,电池反应为:2PbSO4(s)+2H2O(l)?Pb(s)+PbO2(s)+2H2SO4(aq),电池中硫酸的浓度不断变大,故B错误;
C、放电时该电池的负极材料是铅,负极上电极反应式为:Pb(s)+SO42-(aq)-2e-═PbSO4(s),故C正确;
D、放电时正极发生得电子的还原反应,电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l),故D错误.
故选C.
点评:本题考查了原电池和电解池原理,根据元素化合价变化确定电极反应式,再结合物质间的反应来分析解答,充电时,原来的负极作电解池阴极,正极作电解池阳极,难度不大.

练习册系列答案
相关题目
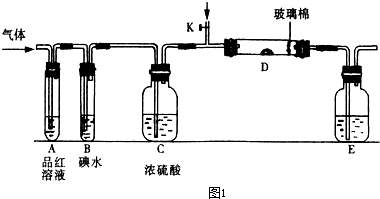

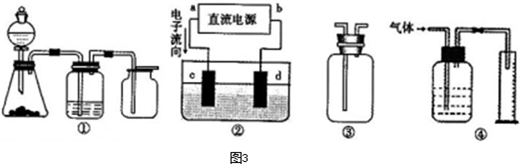
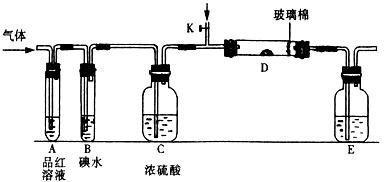
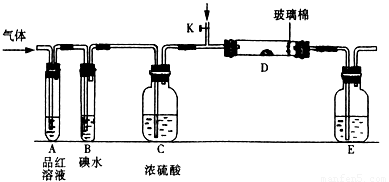
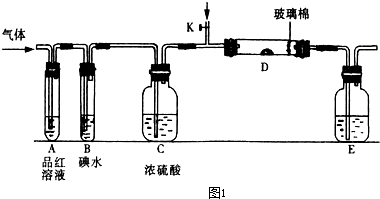
 入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的
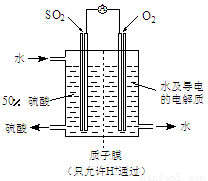
入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
液 D.硫化钠溶液 l2与含X的溶液反应的离子方程式 。
l2与含X的溶液反应的离子方程式 。


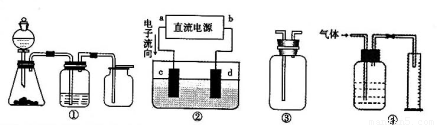
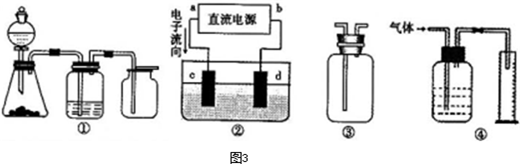
 ,a为正扳,d为阳极
,a为正扳,d为阳极 2、NH3、Cl2,、HCl、NO2等
2、NH3、Cl2,、HCl、NO2等 .装置④能用于测量气体体积
.装置④能用于测量气体体积