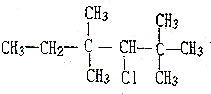题目内容
13.下列各组物质中,所含电子总数相等的是( )| A. | 等物质的量的N0和CO | B. | 等物质的量的CO和N2 | ||
| C. | 等物质的量的C02和C0 | D. | 等物质的量的Mg和Al |
分析 在原子中,核内质子数等于核外电子数,分子是由原子构成的,分子的电子总数就等于构成分子的各原子的电子数之和.
解答 解:A、碳原子有6个电子,氧原子有8个电子,CO中电子总数是14,氮原子的有7个电子,NO中核外电子总数是15,则等物质的量的N0和CO所含电子总数不相等,故A错误;
B、氮原子的有7个电子,N2中电子总数是14,碳原子有6个电子,氧原子有8个电子,CO中电子总数是14,则等物质的量的CO和N2所含电子总数相等,故B正确;
C、碳原子有6个电子,氧原子有8个电子,CO中电子总数是14,C02中电子总数是22,则等物质的量的C02和C0所含电子总数不相等,故C错误;
D、M有12个电子,Al有13个电子,则等物质的量的Mg和Al所含电子总数不相等,故D错误.
故选B.
点评 本题主要考查了分子或原子中电子数的计算,对于常见的微粒,能够计算微粒中的质子数和电子数,题目难度不大,注意根据原子序数或质子数判断电子数.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
3.设NA代表阿伏加德罗常数,下列对于0.3mol/L的H2SO4溶液的说法不正确的是( )
| A. | 2L溶液中含有0.6NA个SO42-离子 | |
| B. | 2L溶液中H+离子的浓度为1.2mol/L | |
| C. | 1L溶液中含有H+离子0.6mol | |
| D. | 1L溶液中含溶质阴阳离子的总数为0.9NA个 |
4.下列有关溶液中各种离子浓度的关系错误的是( )
| A. | 0.1mol•L-1NH4Cl溶液中:(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1NaHSO3溶液中:c(SO32-)+c(HSO3-)+c(H2SO3)=0.1mol•L-1 | |
| C. | 0.1mol•L-1KAl(SO4)2溶液中:c(SO42-)=c(Al3+)+c(K+) | |
| D. | 0.1mol•L Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
1.对0.1mol•L-1的BaCl2溶液的有关叙述中,正确的是( )
| A. | 该溶液中Cl-的物质的量浓度为0.2 mol•L-1 | |
| B. | 该溶液中Ba2+的物质的量浓度为0.1 mol•L-1 | |
| C. | 可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制 | |
| D. | 将20.8 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为0.1 mol•L-1 |
8.下列粒子结构示意图中,表示阳离子的是( )
| A. | 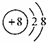 | B. | 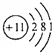 | C. |  | D. |  |
18.反应 A+B→C 的反应速率方程式为:v=k•c(A)•c(B),v为反应速率,k为速率常数.当c(A)=c(B)=1mol/L时,反应速率在数值上等于速率常数.下列说法正确的是( )
| A. | c(A)增大时,v也增大 | B. | c(B)增大时,k也增大 | ||
| C. | 升高温度时,k值不变 | D. | 升高温度时,v值增大 |
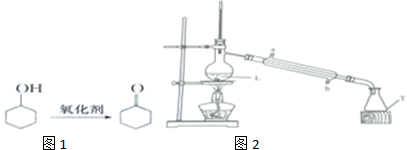
3.环己酮是如图1种重要的化工原料、有机溶剂.
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
制备粗产品:
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.
提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.

提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%