题目内容
将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
 CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的| A.11.5倍 | B.5.75倍 | C.23倍 | D.30.67倍 |
A
根据反应的方程式可知,反应前后体积不变,所以混合气的平均相对分子质量是(28+18)÷2=23。由于气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气的23÷2=11.5倍,答案选A。

练习册系列答案
相关题目
 CO2(g)+NO(g),(正反应放热),
CO2(g)+NO(g),(正反应放热), N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( )
N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( ) Y(g)+Z(s),以下能说明反应达到平衡标志的( )
Y(g)+Z(s),以下能说明反应达到平衡标志的( ) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是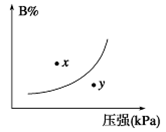
 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是
2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是 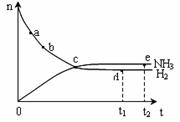
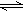 2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是
2Z(g)。下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是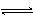 4NO(g) + 6H2O(g),下列叙述正确的是( )
4NO(g) + 6H2O(g),下列叙述正确的是( )