题目内容
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )

A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
【答案】C
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时![]() >
> ![]() ,由图象可知N为lg
,由图象可知N为lg![]() 的变化曲线,M为lg
的变化曲线,M为lg![]() 的变化曲线,当lg
的变化曲线,当lg![]() 或lg
或lg![]() = 0时,说明
= 0时,说明![]() 或
或 ![]() =1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
=1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
A. 由以上分析可知曲线N表示pH与lg![]() 的变化关系,曲线M表示pH与lg
的变化关系,曲线M表示pH与lg![]() 的变化曲线,故A项错误;
的变化曲线,故A项错误;
B. 由图象可知,lg![]() = 0时,即
= 0时,即![]() =1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
=1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
C. 由图象可知当混合溶液呈中性时,lg![]() > 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
> 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
D. lg![]() = 0时,
= 0时,![]() =1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
=1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
答案选C。

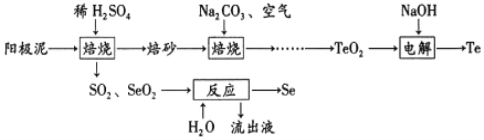
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
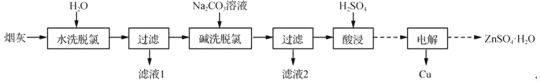
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
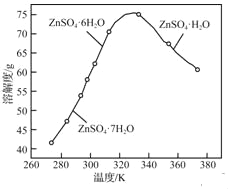
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在