题目内容
12.分子中只含有极性键,但属于非极性分子的是( )| A. | Na2O2 | B. | CO2 | C. | SO2 | D. | C2H4 |
分析 同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;结构对称,正负电荷的中心重合,则为非极性分子;结构不对称,正负电荷的中心不重合,则为极性分子,极性分子、非极性分子属于共价化合物,以此解答该题.
解答 解:A.为离子化合物,含有离子键和非极性键,故A不选;
B.含有非极性键,结构对称,为非极性分子,故B选;
C.结构不对称,为非极性分子,故C不选;
D.含有极性键和非极性键,故D不选.
故选B.
点评 本题考查了键的极性和分子的极性,为高频考点,侧重考查学生的分析能力,题目综合性强,难度中等,注意掌握分子极性的判断方法.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
3.减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注.
I.利用工业废水中的CO2制取甲醇,反应为CO2+3H2$\stackrel{催化剂}{?}$CH3OH+H2O.
(1)已知下列反应的能量变化如图1所示:
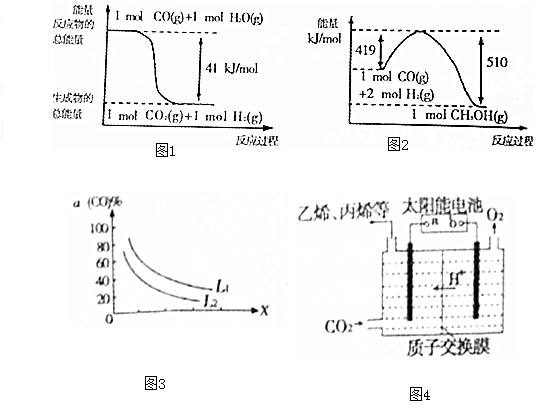
由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
II.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g).
(2)一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol/(L•min).
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1molH2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol.
(4)t℃时,能发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).已知反应平衡常数为400,此温度下,在1L密闭容器中加入-定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是:v(正)>v(逆)(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是1.2mol/L.
(5)已知反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图2所示.图中X表示温度(填“温度”或“压强”),判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件..
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图3所示.b为电源的正极.电解时,生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.
I.利用工业废水中的CO2制取甲醇,反应为CO2+3H2$\stackrel{催化剂}{?}$CH3OH+H2O.
(1)已知下列反应的能量变化如图1所示:

由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
II.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g).
(2)一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol/(L•min).
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1molH2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol.
(4)t℃时,能发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).已知反应平衡常数为400,此温度下,在1L密闭容器中加入-定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(5)已知反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图2所示.图中X表示温度(填“温度”或“压强”),判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件..
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图3所示.b为电源的正极.电解时,生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.
20.下列图示与对应的叙述相符的是( )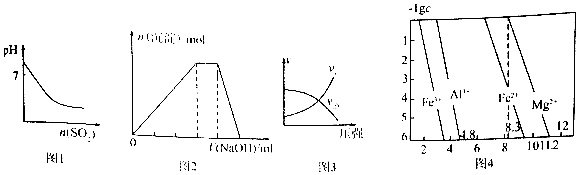

| A. | 图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化 | |
| B. | 图2表示向NH4A1(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化 | |
| C. | 图3表示T°C时,对于可逆反应:A(g)+B(g)?2C(g)+D(g)△H>0,正、逆反应速率与压强的关系 | |
| D. | 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH=7的溶液中,Fe3+、A13+、Fe2+能大量共存 |
7.某链状烃与苯互为同分异构体,其官能团只有碳碳叁键,则该烃的结构可能有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
17.下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝热反应 | ||
| C. | 铝与稀盐酸 | D. | 灼热的炭与CO2反应 |
19.下列溶液中,加入适量KSCN溶液后,溶液变成血红色的是( )
| A. | AlCl3溶液 | B. | FeCl3溶液 | C. | NaCl溶液 | D. | Cu(NO3)2溶液 |
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.