题目内容
【题目】在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空::
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 。
(4)滴定前平视,滴定终点俯视滴定管刻度 ,使滴定结果 。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,使滴定结果 。
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
【答案】(1)偏高 (2)偏高 (3)偏高 (4)偏低 (5)偏低 (6)偏低 (7)偏高 (8)无影响
【解析】中和滴定误差分析的依据是c待=![]() ,,若向待测溶液(置于锥形瓶)中滴加标准溶液(置于滴定管),则由V标来分析实验误差。
,,若向待测溶液(置于锥形瓶)中滴加标准溶液(置于滴定管),则由V标来分析实验误差。
(1)滴定管装液前未用标准溶液润洗,,会使标准溶液被稀释,,导致所耗V标偏大,,使测定的c待偏高。
(2)锥形瓶装液前用待测溶液润洗,,会使锥形瓶内待测的溶质增加,,导致所耗V标偏大,,使测定的c待偏高。
(3)气泡的体积计入了标准溶液,,使结果偏高。
(4)滴定终点俯视读数,,V标偏低,因而c待偏低。
(5)终点判断提前(应保持半分钟不褪色,),结果偏低。
(6)NaOH中含有Na2O,则标准溶液的浓度已经偏高(62 g Na2O相当于80 g NaOH),因而所需滴入的标准溶液的体积偏小,测得结果偏低。
(7)把标准溶液视为Na2CO3溶液,由于53 g Na2CO3相当于40 g NaOH,所以中和相同量的盐酸所需Na2CO3溶液的体积比NaOH溶液的体积大,使V标偏高,结果偏高。
(8)食盐水对结果无影响。

【题目】如图为10 mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示可推出HCl和NaOH的物质的量浓度( )
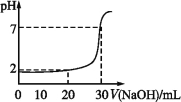
选 项 | A | B | C | D |
HCl物质的量浓度/(mol·L-1) | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH物质的量浓度/(mol·L-1) | 0.04 | 0.12 | 0.09 | 0.03 |